Pile.
On étudie la pile formée par les couples Zn2+/Zn et Cu2+/Cu.
A- Il s'agit de la pile
de de Volta. Faux.
Pour la pile de Volta, l'électrolyte est du vinaigre.
B-
Il s'agit de la pile Danielle. Vrai.
Il s'agit de la pile Daniell " sans
e à la fin".
C- Il y a oxydation au pole positif.
Faux.
L'oxydation du zinc ( Zn = Zn2++2e-) libère des
électrons : l'électrode de zinc, l'anode, est donc négative.
D- On note conventionnellement cette
pile : Zn2+aq |Zn(s) || Cu2+aq| Cu(s). Faux.
Zn(s) | Zn2+aq || Cu2+aq| Cu(s).
E- Le symbole || indique
la séparation entre les demi-piles qui est une condition nécessaire à
la naissance du courant. Vrai.
Chaque barre représente un changement de phase. Aux deux extrémités on
note les électrodes. La double barre au milieu sert à séparer les deux
constituant de ta pile. Par convention la zone anodique est toujours
écrite à gauche.
pKa et force
d'un acide.
A- Un acide faible est d'autant plus
fort que le pKa du couple auquel il appartient est élevé. Faux.
A concentration apportée égale, un acide faible est d'autant plus fort
que pKa est plus petit ( Ka plus grand).
B-
Plus le pKa d'un couple acide / base est petit, plus l'acide du couple
est dissocié dans l'eau, à concentration apportée égale. Vrai.
C- Plus un acide faible est dilué,
plus il a tendance à être fort. Vrai.
AHaq + H2O = H+aq + A-aq. L'ajout
d'eau ( dilution) déplace l'équilibre vers la droite, sens direct,
dissociation de l'acide.
Par dilution, un acide faible à tendance à se comporter comme un acide
fort,
" à concentration apportée égale".
D- La dilution n'a aucune influence
sur la dissociation d'un acide AH dans l'eau. Faux.
E- Lorqu'un acide est faible dans
l'eau, sa base conjuguée est forte dans l'eau. Faux.
|
Conductivité.
On connaît les conductivités molaires dans les conditions standards de
différentes solutions :
LNaCl
= 126 10-4 S m2 mol-1 ; LHCl = 425 10-4 S m2 mol-1 ; LH2SO4 = 860 10-4 S m2 mol-1 ;
A- la conductivité de la solution
d'acide sulfurique est bien plus grande que les autres valeurs car
c'est un diacide. Vrai.
B- Pour les conductivités
molaires ioniques, on a la relation : lH+ aq < lNa+ aq . Faux.
C- LNa2SO4 = 687 10-4 S m2 mol-1. Faux.
LNa2SO4 = 2 lNa++ lSO4
2- ; LNaCl =lNa+
+ lCl-
; LHCl =lH+
+lCl-
; LH2SO4 =2lH++ lSO4
2- ;
LNa2SO4 =2 LNaCl -2
LHCl + LH2SO4 =(252-850+860)10-4 = 262 10-4
S m2 mol-1.
D- LNa2SO4 = 262 10-4 S m2 mol-1. Vrai.
E- La conductivité molaire standard LNa2SO4 ne vaut
aucune des valeurs précédentes. Faux.
|
Oxydation
ménagée par l'ion permanganate de monoalcools.
A- Tous les alcools sont
oxydés. Faux.
Un alcool tertiaire ne subit pas d'oxydation ménagée.
B- Les alcools tertaires
sont oxydés en acide carboxylique. Faux.
C- Les alcools primaires
s'oxydent tous en aldehydes. Vrai.
Si l'oxydant est en défaut, un alcool primaire s'oxyde en aldehyde ; si
l'oxydant est en excès, un alcool primaire s'oxyde en acide
carboxylique.
D- Les alcools secondaires s'oxydent
en cétone. Vrai.
E- Toutes les réponses
précédentes sont fausses. Faux.
titrage
acide base (soude).
Une prise d'essai de volume V0 d'une solution d'un monoacide
fort AH de concentration en acide apportée c0 est titrée
par une solution de soude de concentration c1.
On exprime le volume de soude versé par la valeur V et on pose x= V / VE
où VE est le volume de soude versé à l'équivalence.
A- On peut définir l'équivalence du
titrage par x =c1V/ ( V0c0)=1 . Vrai.
A l'équivalence : V = VE et x=1 ; V0c0=
c1VE. Il vaudrait mieux écrire x =c1VE/
( V0c0)=1 .
B-
La concentration en A- initialement présente vaut : [A-aq]i
=V0c0/ V. Faux.
La valeur initiale de V est nulle ( on ne peut pas diviser par zéro). [A-aq]i =[H3O+aq]i ~(Kac0)½.
C- Avant
l'équivalence, la concentration en ions oxonium restants est : [H3O+aq]
=V0c0(1-x)/
(V+V0) . Vrai.
La
solution est électriquement neutre, le pH est inférieur à 7 ( HO-
en défaut est négligeable devant H3O+aq : [Na+aq] +[H3O+aq]= [A-aq] ;
[Na+aq]= c1V/ (V+V0) ; [A-aq] = c0 V0/ (V+V0) ;
[H3O+aq] =c0 V0/ (V+V0) -c1V/ (V+V0) =(c0 V0 -c1VEx) / (V+V0) avec c0 V0 =c1VE
D- Le meilleur
indicateur coloré pour ce titrage est la phénolphtaléine. Faux.
Zone de virage de la phénolphtaléine [8 ; 10 ] ; le pH du point
équivalent doit appartenir à la zone de virage.
Il s'agit d'un titrage acide fort base forte : le pH à l'aquivalence est égal à 7.
E- A l'équivalence du titrage [H3O+aq]équi =
1,0 10-6 mol/L. Faux.
[H3O+aq]équi
est de l'ordre de 10-6 mol/L, cela dépend du pKa du couple
acide / base. 1,0 10-6
est trop précis.
Solubilité du
chlorure de plomb PbCl2.
La solubilité du chlorure de plomb est s = 5,00 mol/L à
25°C. La constante d'équilibre K associée à la réaction de
solubilisation du chlorure de plomb vaut :
1,00 105 ; 125 ; 500 ; 20,0 ;
PbCl2(s) = Pb2+aq + 2Cl-aq ; K = [Pb2+aq][Cl-aq]2
;
La solution est électriquement neutre : 2[Pb2+aq]=2*5,00
= 10,0 =[Cl-aq] ; K = s *(2s)2 = 4s3.
K =5,00*10,02 =500.
E- il est possible
de diminuer les concentrations des espèces en solution saturée en
modifiant la température de la solution.
Vrai.
La solubilité diminue quand la température décroît.
Acide
acétique.
On prépare une solution S d'acide acétique de conductivité s = 0,020 S m-1 et de
concentration en soluté apportée c1 = 2,0 10-2
mol/L.
lH3O+ = 35 10-3
S m2 mol-1 ; lCH3-COO-
= 5,0 10-3 S m2 mol-1 ;
A- Cette réaction est
limitée et [CH3COO-]éq = 0,50 mol m-3. Vrai.
s =lCH3-COO-[CH3COO-]éq
+ lH3O+[H3O+aq]éq
;
la solution est électriquement neutre : [H3O+aq]éq
=[CH3COO-]éq =s / (lCH3-COO- + lH3O+ ) =20/(35+5) =
0,50 mol m-3.
B- Cette réaction est limitée et [CH3COO-]éq
= 500 mol dm-3. Faux.
0,50 mol m-3=0,50 10-3
mol dm-3= 0,50 10-3 mol / L.
C-
la constante d'équilibre associée à la réaction de l'acide acétique sur
l'eau vaut K = 12,5. Faux.
K = [CH3COO-]éq
[H3O+aq]éq / [AH]éq =
[H3O+aq]2éq /(c1
-[H3O+aq]éq )= (0,50 10-3 )2
/(0,02-0,50 10-3 )= 1,28 10-5.
D- la constante
d'équilibre associée à la réaction de l'acide acétique sur l'eau vaut K
=12,5 10-6. Vrai.
E- La conductivité de la solution S dépend
fortement de sa température. Faux.
le mot " fortement " est
inutile.
Les
corps gras.
A- Ils répondent à la formule
générale suivante, où R, R', R" désignent des chaînes carbonées.
Faux.
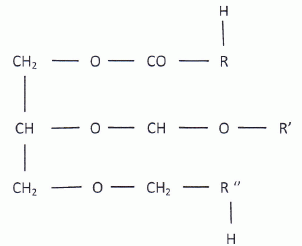
faux
|
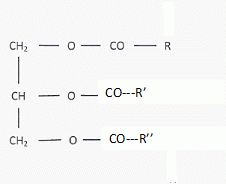
Vrai
|
B- sont des triesters. Vrai.
C- sont des produits de la
saponification. Faux.
La
saponification d'un corps gras donne un savon.
D- sont des triglycérides. Vrai.
E- ont la propriété
d'être des acides. Faux.
Evolution
spontanée d'une réaction chimique.
Soit une réaction de quotient de réaction Qr et de constante
d'équilibre K.
A- l'équation chimique s'écrit
obligatoirement avec un signe = . Faux.
B- le système chimique
n'évolue pas si Qr < K. Faux.
évolution dans le sens direct.
C-
le système chimique évolue dans le sens direct de l'écriture de
la réaction si Qr > K. Faux.
évolution dans le sens indirect.
D- le système chimique
peut évoluer vers l'équilibre et la réaction chimique être athermique.
Vrai.
E- le système chimique ne
peut évoluer que dans le sens d'une réaction exothermique. Faux.
Titrage acide
base.
L'équation chimique support du titrage par la soude d'une solution d'un
acide AH se dissociant totalement dans l'eau est :
A-
AH aq + HO-aq = A-aq + H2O(l).
Faux.
"AH se
dissociant totalement dans l'eau" signifie " acide fort".
B- H3O+aq + HO-aq
=2H2O(l). Vrai.
C- AH aq + B-aq = A-aq + BH(aq).
Faux.
Un titrage équivaut à
un dosage.
D- Vrai car sa mise en
oeuvre est la même.
Faux.
Un titrage est une technique de dosage.
F- Faux car l'un vise à déterminer une quantité de matière et
l'autre fait toujours appel à une réaction chimique.
Vrai.
Titrage : on fait appel à une réaction chimique. Exemple : titrage
acide base.
Dosage : il faut d'abord établir une courbe étalon, puis l'utiliser
pour déterminer la quantité de matière inconnue.
exemple : dosage par spectrophotométrie.
Soit la réaction
: 2H2O(l) =H3O+aq + HO-aq :
A- elle
n'a lieu que dans l'eau pure.
Faux.
elle se
produit dans toute solution aqueuse.
B- elle correspond à la dismutation de l'eau.
Faux.
autoprotolyse de l'eau .
C- elle prouve que l'eau est de la famille des
ampholytes.
Vrai.
Un ampholyte se comporte comme un acide ou comme une base.
D- elle permet de
calculer le pH de neutralité de l'eau pure en fonction de la
température.
Vrai.
F- toutes ces affirmations sont fausses.
Faux.
|
A- un
alcool tertiaire se caractérise avec le bleu de bromothymol.
Faux.
elle se
produit dans toute solution aqueuse.
B- le 2,3-diméthylbutanal a pour formule C6H12O. Vrai.
CH3-CH(CH3)-CH(CH3)-CHO.
C- le 2-méthylpropanal et la butanone sont isomères.Vrai.
CH3-CH(CH3)-CHO
et CH3-CO-CH2-CH3.
Ils ont la même formule brute.
D- la 2,4-DNPH
réagit avec une cétone.Vrai.
F- un alcool primaire et un alcool
tertiaire peuvent être isomères.Vrai.
L'ion
benzoate est une base faible.
C6H5COO- aq + H2O(l) = C6H5COOH
aq + HO-aq.
A-La
constante d'équilibre s'écrit : K =[C6H5COOH aq]éq [HO-aq]éq / [C6H5COO-
aq]éq . Vrai.
B- le quotient de réaction associé à la réaction
précédente est nul à l'équilibre.
Faux.
le quotient de
réaction à l'équilibre est égal à la constante d'équilibre.
On ajoute des ions hydroxyde à une solution aqueuse d'ion benzoate :
C- K
augmente. Faux.
K ne dépend que de la
température.
D- on déplace l'équilibre dans le
sens indirect.Vrai.
L'équilibre est déplacé dans le sens de la consommation des ions
hydroxydes.
F-On modifie la
température : K reste inchangé. Faux.
|

