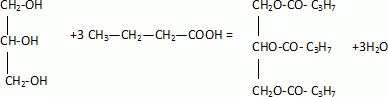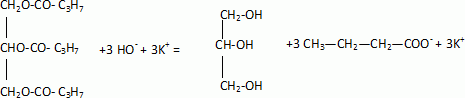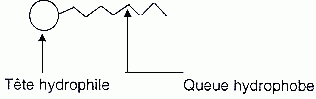Le
zinc
On donne : Fe2+aq + Zn(s) = Zn2+aq
+ Fe(s) (1)
; constante d'équilibre K1 = 1,40 1011 à 25°C.
On dispose :
- d'une solution aqueuse S1 de sulfate de fer (II) de
concentration en soluté apporté 5,00 10-2 mol/L
- d'une solution aqueuse S2 de
sulfate de zinc (II) de concentration en soluté apporté 2,00 10-1
mol/L.
Toutes les expériences se déroulent à 25°C. On ne prendra en compte que
les couples oxydant / réducteur suivants : Fe2+aq/Fe(s) ; Zn2+aq
/ Zn (s) et H+aq / H2(g).
Expérience 1 :
A l'instant t=0, on mélange, dans un grand becher, 200 mL de solution S1,
100 mL de solution S2,
5,56 g de fer et 6,54 g de zinc, puis on agite. On étudie la
transformation de ce système chimique modélisée par l'équation (1).
Ecrire les
demi-équations électroniques intervenant dans la réaction (1) et donner la nature
de chacune des demi-réactions qui se produisent.
Fe2+aq + 2e- = Fe(s)
: réduction de Fe2+aq
Zn(s) = Zn2+aq + 2e- : oxydation de Zn(s).
Déterminer
les quantités de matière d'ion fer(II) et d'ion zinc (II) initiales.
n(Fe2+)0 =0,200 * 5,00 10-2 = 1,00 10-2 mol.
n(Zn2+)0 =0,100 * 2,00 10-1
= 2,00 10-2 mol.
Calculer
le quotient de réaction associé à l'équation (1) dans l'état initial.
Qr i = [Zn2+aq]0 / [Fe2+aq]0 = n(Zn2+)0/n(Fe2+)0 =2.
Quel est le sens
d'évolution spontané du système chimique étudié ?
Qr i < K : le système chimique
évolue spontanément dans le sens direct.
L'avancement dans l'état final est égal à 1,00 10-2 mol.
Construire le
tableau descriptif du système étudié et déterminer les quantités de
matière des espèces présentes à l'état final.
|
avancement
(mol)
|
Fe2+aq |
+ Zn(s) |
= Zn2+aq |
+ Fe(s) |
initial
|
0
|
1,00 10-2 |
6,54 /
65,4 = 0,100
|
2,00 10-2 |
5,56 /
55,6 = 0,100
|
en
cours
|
x
|
1,00 10-2-x
|
0,100-x
|
2,00 10-2+x
|
0,100+x
|
final
|
xf |
1,00 10-2-xf
|
0,100-xf |
2,00 10-2+xf |
0,100+xf |
| 1,00 10-2 |
0
|
0,1-0,01
=0,0900
|
3,00 10-2 |
0,110
|
Fe2+aq est en défaut : 1,00 10-2-xf = 0 : xf =1,00 10-2 mol.
|
Expérience 2 :
On réalise le montage d'électrolyse schématisé ci-après. La solution
électrolysée est une solution aqueuse de sulfate de zinc (II).
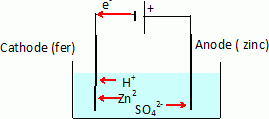
Lorsque le circuit est fermé, on observe sur l'électrode de fer la
formation d'un dépôt métallique et un dégagement de dihydrogène.
Ecrire
les demi-équations électroniques se produisant à l'électrode de fer.
Le fer, relié à la borne négative du générateur, est une cathode où se
déroulent des réductions ; les oxydants Zn2+aq et
H+aq
gagnent des électrons.
Zn2+aq
+ 2e- = Zn(s) ; 2H+aq + 2e- = H2(g).
|
Quel
est l'intérêt pratique de ce dépôt métallique sur le fer ?
Le zinc recouvre le fer et le protège d'une oxydation par le dioxygène
de l'air. Le zinc, plus réducteur que le fer, est oxydé et le fer est
protégé tant qu'il y a du zinc.
Comment
évolue la masse de l'électrode de zinc ?
L'anode en zinc s'oxyde : sa masse diminue.
Zn(s) = Zn2+aq +
2e-.
Comment
appelle t-on une telle électrolyse ?
Electrolyse à anode soluble.
Comment ôter une tache de beurre ?
L'acide butanoïque ou acide butyrique, noté A est un acide carboxylique de formule semi-développée CH3-CH2-CH2-COOH.
Nommer et mettre en évidence le groupe caractéristique.
CH3-CH2-CH2-COOH ; groupe carboxy.
L'action de l'acide butanoïque sur un réactif B conduit à la formation de C et D. C a pour formule semi-développée CH3-CH2-CH2-COO-CH2-CH2-CH3.
Nommer le produit C. A quelle famille appartient-il ?
C est un ester : le butanoate de propyle.
Ecrire la formule semi-développée de B et donner son nom.
propan-1-ol : HO-CH2-CH2-CH3, alcool primaire.
Quelle est la nature du produit D ?
D est de l'eau H2O.
La butyrine ou tributyrate de glycéryle est un corps gras présent dans
le beurre. Cette molécule résulte de l'action de l'acide butyrique sur
le glycérol de formule HOCH2-CH(OH) -CH2OH.
Ecrire l'équation modélisant la réaction de synthèse de la butyrine.
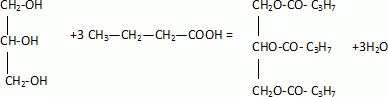
On mélangeune masse m1 = 26,4 g d'acide butyrique et une quantité de matière n2 =0,100 mol de glycérol.
Le mélange est-il stoechiométrique ?
Masse molaire de l'acide butyrique M = 4*12+8+32 =88 g/mol.
Quantité de matière d'acide butyrique n = m1/M =26,4 / 88 =0,300 mol.
A partir de 0,1 mol de glycérol il faut 3*0,1 = 0,3 mol d'acide butyrique. Le mélange est stoechiométrique.
Après addition de quelques grains de pierre ponce, on chauffe à reflux
ce mélange réactionnel. On obtient une masse m = 19,0 g de butyrine.
Calculer le rendement de cette synthèse.
Quantité de matière théorique de butyrine : 0,1 mol ; masse molaire de la butyrine : M = 15*12+26+6*16 =302 g/mol.
masse théorique de butyrine : 0,1*302 = 30,2 g.
rendement : masse réelle / masse théorique = 19,2 / 30,2 =0,636. ( 63,6 %)
|
Le
beurre contient plusieurs corps gras : l'oléine, la palmitine et la
butyrine. La butyrine représente 35 % en masse du beurre. On étudie la
fabrication d'un savon à partir de la butyrine. Pour cela on fait
réagir 40,0 g de beurre avec un excès de potasse KOH concentrée. On
chauffe ce mélange pendant 30 min. Après relargage, on observe la
formation d'un précipité jaune.
Nommer la réaction qui conduit à la formation du précipité et écrire l'équation la modélisant.
Donner deux caractéristiques de cette réaction.
Saponification du triester, réaction chimique lente, totale.
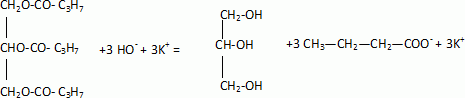
Après élimination de l'excès de potasse, on étudie les qualités détergentes du savon sur une tache de beurre.
Représenter schématiquement l'action du savon sur la tache de beurre.
On schématise l'ion butyrate de la manière suivante :
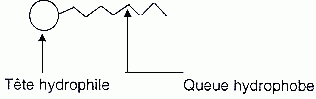
Le schéma ci-dessous
représente une micelle de type " huile, graisse dans l'eau".
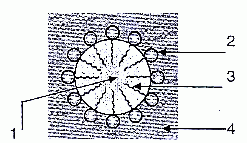
1 : huile, graisse
2 : partie hydrophile du tensioactif
3 : partie hydrophobe du tensio-actif
4 : eau.
|
|