|
Pyrométallurgie du zinc, électrolyse, concours technicien de l'industrie et des mines 2008. |
|||||||
|
|||||||
|
Ecrire l'équation de la réaction de grillage. ZnS(s) + 1,5O2(g) = ZnO(s) + SO2(g). Déterminer la quantité de matière (moles) correspondant à 2,0 tonnes de blende. M(Zn) = 65,4 ; M(S) = 32,1 g/mol. Masse molaire de ZnS : M =65,4 +32,1 =97,5 g/mol ; m = 2,0 106 g. n = m / M = 2,0 106 / 97,5 =2,051 104 ~2,1 104 mol. Déterminer la quantité de matière de dioxygène nécessaire pour le grillage ainsi que les quantités de matière d'oxyde de zinc et de dioxyde de soufre formés. D'après les nombres stoechiométriques de l'équation : n(ZnO) = n(SO2 ) =n = 2,1 104 mol. n(O2) = 1,5 n = 1,5 *2,051 104 =3,077 104 ~ 3,1 104 mol. En déduire le volume de dioxygène nécessaire. Vm = 25 L/mol.. V = n(O2) Vm =3,077 104 *25 =7,692 105 ~7,7 105 L = 7,7 102 m3. Quelle est la masse d'oxyde de zinc produite ? M(ZnO) = 65,4+16 = 81,4 g/mol. m = M(ZnO) n(ZnO) =2,051 104 *81,4 =1,67 106 g ~1,7 t. Quel est le volume de dioxyde de soufre ainsi recueilli ? V = n(SO2) Vm =2,051 104 *25 =5,1 105 L = 5,1 102 m3.
Etude
de la transformation.
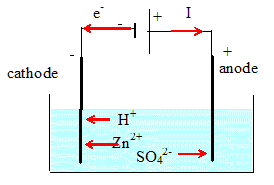
Exploitation des résultats. L'électrolyse a lieu sous 3,5 V. L'intensité du courant peut atteindre 80 kA. Après 48 heures de fonctionnement,le dépôt de zinc est sufisamment épais. Il est alors séparé de l'électrode, fondu et coulé en lingots. Calculer la quantité d'électricité Q circulant dans l'électrolyseur en 48 heures. Q = I t = 8 104 * 48*3600 =1,3824 1010 ~1,4 1010 C. En déduire la quantité de matière d'électrons qui circule. n(e-)= Q / 96500 =1,3824 1010 /96500 = 1,4325 105 ~ 1,4 105 mol. Déterminer la quantité de matière de zinc formé en 48 heures. Zn2+aq + 2e- = Zn(s). n(Zn) = ½ n(e-)= 0,5*1,4325 105 =7,1627 104 ~7,2 104 mol. En déduire la masse de zinc produire en 24 heures. m= n(Zn) M(Zn) = 7,1627 104 *65,4 =4,68 106 g ~ 4,7 t. En fait on obtient une quantité de matière de zinc inférieure. Pourquoi ? Réduction de H+aq à la cathode : 2H+aq + 2e- = H2(g). Réduction concurente de celle du zinc.
|
|||||||
| |
|||||||
|
|