|
Polution au dioxyde de soufre, combustibles propres, concours technicien de l'industrie et des mines 2009. |
|||||||
|
|||||||
|
Une centrale thermique brule un charbon dont la teneur en soufre est de 1,0%. La consommation horaire en charbon est de 206 tonnes. Ecrire l'équation de la réaction de combustion complète du soufre S dans le dioxygène. S(s) + O2(g) = SO2(g) Calculer la masse puis la quantité de matière ( moles) de soufre brulé en une heure. masse m = 206*0,01 = 2,06 t = 2,06 106 g. Masse molaire du soufre : M = 32 g/mol Quantité de matière de soufre n = m / M = 2,06 106 /32 =6,4375 104 ~ 6,4 104 mol. Déterminer la quantité de matière de dioxyde de soufre formé en une heure. D'après les nombres stoechiométriques de l'équation , il se forme une mole de SO2 pour une mole de soufre brûlé. n(SO2) = 6,4 104 mol.
Pour
lutter contre la pollution atmosphérique par le dioxyde de soufre, on
mélange le charbon avec du calcaire ou carbonate de calcium CaCO3 pulvérisé avant de le faire brûler. L'équation de la réaction s'écrit : Combustibles propres. la production de dioxyde de carbone lors de la combustion
complète d'hydrocarbures accroït l'effet de serre. Par conséquent, dans
le choix d'un combustible, l'énergie de réaction libérée par mole de
dioxyde de carbone formé est un critère intéressant.
L'équation de combustion du méthane s'écrit : CH4 + 2O2 = CO2 + 2H2O. 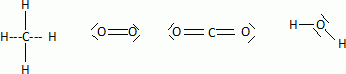 faire le bilan des liaisons rompues et des liaisons créées
|
|||||||
| |
|||||||
|
|