La méthode utilisée paermet de doser les ions chlorure par précipitation avec les ions argent (I) Ag+.
Le chlorure d'argent formé est un solide blanc colloïdal. L'équivalence
du dosage sera déterminée en utilisant un indicateur coloré.
Les solides colloïdaux ont la propriété d'adsorber les ions présen,ts
en solution. La méthode de fajans utilise cette propriété et utilise un
indicateur coloré d'adsorption : la dichlorofluorescéine.
En effet au cours du dosage des ions chlorures Cl-aq, les ions chlorures sont en excès et forment un assemblage [AgCl(s), Cl-adsorbé] qui, en présence de dichlorofluorescéine, est jaune vert.
Après l'équivalence, les ions Ag+ aq sont en excès et forment un assemblage [AgCl(s), Ag+adsorbé] qui, en présence de dichlorofluorescéine, est rose.
La présence en solution aqueuse des ions sodium, nitrate et chlorure ne modifie pas la couleur de la dichlorofluorescéine.
Préparation de l'indicateur coloré d'adsorption.
On
désire préparer une solution S éthanolique à 0,1 % en masse de
dichlorofluoresceine. La dichlorofluorescéine dont on dispose au
laboratoire est un solide dihydraté de formule statistique C20H10O5Cl2, 2H2O. Le solvant est l'alcool absolu. d'après l'INRS, les fiches de sécurité portent les indications suivantes :

Donner le type de renseignements indiqués dans les phrases R et S d'une fiche toxicologique.
R : risques encourus en utilisant le produit.
S : mesures de sécurité à mettre en oeuvre.
|
On donne ci-après un ensemble de pictogrammes de sécurité trouvés sur les emballages de produits chimiques :
 Donner le(s) pictogramme(s) devant être placé(s) sur le flacon d'alcool absolu.
6 : facilement inflammable.
Donner le(s) pictogramme(s) devant être associé(s) à la 2,7-dichlorofluorescéineu.
7 : nocif, irritant pour les yeux, la peau, les voies respiratoires.
|
Calculer la masse m de 2,7-dichlorofluorescéine correspondant à un volume de 50,0 mL de solution S.
Masse de 50,0 mL d'alcool absolu ( le solvant) : 50,0*0,79 =39,5 g
Masse de 2,7-dichlorofluoreséine : 0,1 * 39,5 / 100 ~0,040 g ou 40 mg.
Expliquer la raison pour laquelle il conviendra de préparer plus de 50,0 mL de cette solution.
Peser
40 mg de solide nécessite une balance de très grande précision.
Il vaudrait mieux préparer 200 mL de solution d'indicateur coloré en
pesant une masse m = 0,16 g de solide.
Une balance au 1/100è suffirait.
Proposer succinctement un protocole pour réaliser la solution S souhaitée.
Peser 0,16 g de solide ( balance au 1/100è, spatule et coupelle)
Placer dans un fiole jaugée de 200 mL contenant de l'alcool absolu ( rincer l'entonoir et la coupelle avec l'alcool)
Agiter jusqu'à dissolution complète et compléter avec de l'alcool absolu jusqu'au trait de jauge.
Principe du dosage.
On veut doser un volume V1 d'une solution aqueuse S1 d'ion chlorure par une solution aqueuse S2 de nitrate d'argent de concentration C2.
Faire un schéma annoté du dispositif de titrage.
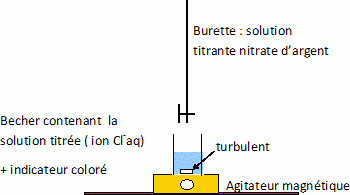
Donner les caractéristiques générales d'une transformation chimique utilisée pour un titrage.
La transformation chimique doit être rapide et totale.
Donner l'équation de la réaction de titrage.
Ag+aq + Cl-aq = AgCl(s)
Calculer la constante d'équilibre K associée à l'équation de réaction de titrage.
On donne le produit de solubilité de AgCl à 298 K : Ks = 1,6 10-10.
K = 1/([Ag+aq][Cl-aq]) = 1/Ks = 1/ 1,6 10-10=6,3 109.
Définitr l'équivalence et expliquer comment l'observer expérimentalement.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
Avant l'équivalence, l'ion chlorure est en excès dans le becher (
couleur jaune vert) ; après l'équivalence, l'ion argent est en excès (
couleur rose).
Donner un argument en faveur de la récupération du milieu réactionnel usagé, c'est à dire après l'équivalence.
L'argent coûte cher et ce métal fait partie des métaux lourds, source de pollution.
Préparation de la solution à doser.
On a prélevé un échantillon d'eau de la mer Morte. On dilue 100 fois cette eau pour obtenir la solution S1 à doser. On souhaite obtenir 500,0 mL de solution S1. Soit C1 sa concentration.
Préciser le matériel nécessaire pour éffectuer cette dilution.
Fiole jaugée de 500,0 mL
Dilution au 1/100è, donc pipette jaugée de 500/100 = 5,00 mL.
|
Exploitation du dosage.
On réalise le dosage d'un volume V1 = 10,0 mL de solution S1 par une solution S2 de nitrate d'argent de concentration C2 = 5,00 10-2 mol/L. Le volume de nitrate d'argent versé à l'équivalence est VE = 10,15 mL.
Décrire une burette appropriée compte tenu de la précision de VE.
Un piston, actionné par un moteur pas à pas pousse dans la burette
automatique de grande précision la solution titrante. Ce moteur est
commandé par l’ordinateur.
Exprimer la concentration molaire C1 en fonction de C2, V1 et VE puis la calculer.
A l'équivalence : C1 V1 = C2 VE ; C1 = C2 VE / V1= 5,00 10-2 *10,15 / 10,0 =5,075 10-2 ~5,08 10-2 mol/L.
En déduire la concentration molaire C des ions chlorure dans l'eau de la mer Morte.
C = 100 C1 = 5,08 mol/L.
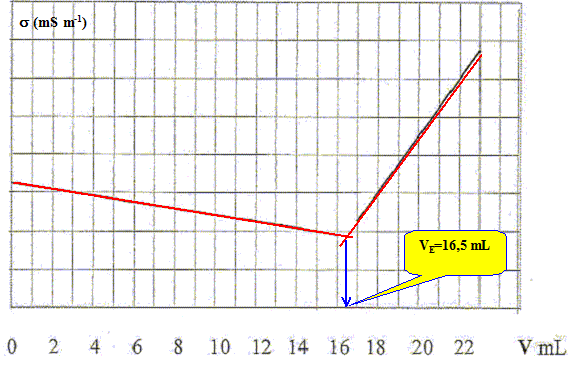
Expliciter une autre méthode permettant de déterminer le volume équivalent.
Suivi conductimétrique du
dosage de 10,0 mL de la solution S1, à laquelle on
a ajouté 200 mL d'eau distillée, par une
solution de nitrate d'argent de concentration c0. L'équivalence est obtenue à l'intersection des deux segments de droite..
|
|



