Etude de l'eau.
Donner pour la
molécule d'eau, la configuration électronique dans leur état
fondamental de chacun des éléments chimiques.
H : 1s1 ; O : 1s2 2s2 2p4.
Donner la
représentation de Lewis de la molécule, sa géométrie d'après la théorie
VSEPR en précisant l'ordre de grandeur de l'angle entre les liaisons OH.
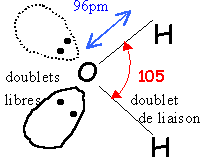
Type AX2E2 ( deux doublets de liaisons et deux
doublets non liants).
La répulsion entre doublets non liants et plus grande que la répulsion
entre doublets liants : l'angle entre les liaisons OH est un peu
inférieur à 109°.
Expliquer
l'origine de la polarité de la molécule d'eau. Caractériser les
substances que l'eau est capable de dissoudre. Donner deux exemples de
composés, l'un soluble, l'autre non soluble dans l'eau.
La molécule d'eau peut être considérée comme un dipole
électrostatique du fait :
- de la polarisation de la liaison O-H (différence d'électronégativité des atomes liés)
- présence de 2 doublets non liants.
Les molécules polaires et les ions ont une grande affinité pour l'eau :
l'eau est capable de les dissoudre.
Le sucre ( glucose), molécule polaire, est soluble dans l'eau.
L'octane, molécule non polaire, ne se mélange pas avec l'eau.
Principaux
éléments de l'eau de mer.
Six éléments suffisent pour décrire la composition de 99 % des sels
dissous dans l'eau. Leur quantité totale et leurs proportions relatives
n'ont pratiquement pas varié depuis un milliard d'années.
ion
|
concentration
dans l'eau de mer g / kg
|
sources
|
chlorure
|
18,97
|
volcanisme,
rivières
|
sodium
|
10,55
|
rivières
|
sulfate
|
2,65
|
volcanisme
|
magnésium
|
1,27
|
rivières
|
calcium
|
0,4
|
volcanisme,
rivières |
potassium
|
0,38
|
rivières |
Citer les familles
chimiques auxquelles appartiennent les différents éléments. Situer ces familles
dans la classification périodique.
chlore : halogènes ; colonne 17 ( avant dernière à droite)
sodium et potassium : alcalins ; 1ère colonne
magnésium et calcium : alcalino-terreux, seconde colonne.
|
Le réseau
cristallin du chlorure de sodium.
Le chlorure
de sodium solide est un assemblage régulier d'ion Na+ et
d'ion Cl-. Il résulte de la répétition d'une figure
élémentaire qui porte le nom de maille cristalline. Dans le cas du
chlorure de sodium,, il s'agit d'une maille cubique à faces centrées.
les ions sont assimilables à des sphères rigides dont les rayons sont r+
= 100 pm pour l'ion sodium et r- = 180 pm pour l'ion
chlorure.
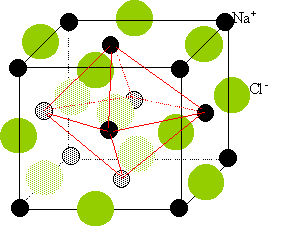
Représenter la
maille du chlorure de sodium.
Deux réseaux cubiques à faces centrées, l'un d'ion Na+,
l'autre d'ion chlorure Cl-. Ces réseaux se déduisent l'un de
l'autre par translation parallèle aux arètes de la maille et de valeur
égale à la moitié du coté de la maille.
Chaque ion est au centre d'un octaèdre, entouré de 6 ions de signe
opposé occupant les 6 sommets.
|
Trouver une relation
simple entre l'arète du cube représentant la maille et les rayons des
ions. En déduire la valeur de a et le volume d'une maille en m3.
Les ions sont considérés comme des sphères en contact : la longueur de
l'arète est égale à deux fois la somme des rayons ioniques.
a =2( r+ + r- )= 2(100 +180) = 560 pm = 5,6 10-10
m.
Volume V = a3 = (5,6 10-10)3 =1,76 10-28
m3.
Donner le nombre et
la nature des particules constituant l'atome de sodium ( Z = 11, A =
23) et l'atome de chlore ( Z = 17, A = 35). Faire de même pour les ion
sodium et chlorure.
Pour
quelle raison la masse de ces ions est-elle pratiquement égale à la
masse des atomes ?
Na : 11 protons positifs, 23-11 = 12 neutrons ; 11 électrons négatifs.
Na+ : 11 protons positifs, 23-11 = 12 neutrons ; 11-1 = 10
électrons négatifs.
Cl : 17 protons positifs, 35-17 = 18 neutrons ; 17 électrons négatifs.
Cl- : 17 protons positifs, 18 neutrons ; 17+1 = 18 électrons
négatifs.
La masse d'un électron est environ 2000 fois plus petite que celle d'un
nucléon : on eut confondre masse de l'atome et masse de l'ion.
Calculer
la masse en kg des ions sodium et chlorure.
masse d'un nucleon mn = 1,67 10-27 kg ; masse
d'un électron me = 9,10 10-31 kg.
mNa+ =23mn +10me = 23*1,67 10-27
+ 10*9,10 10-31 =3,84 10-26 kg
mCl- =35mn +18me = 35*1,67 10-27
+ 18*9,10 10-31 =5,85 10-26 kg.
Donner
les nombres d'ion sodium et chlorure effectivement présents dans une
maille. Quelle argumentation permet d'affirmer que la maille contient
autant d'ion sodium que d'ion chlorure ?
Les ions situés aux sommets du cube appartiennent à 8 cubes et compte
donc pour 1/8 ; or il y a 8 sommets donc 8/1/8 = 1 ion sodium propre à
la maille.
les ions situés aux centre des faces appartiennent à 2 cubes ; or il y
a 6 faces donc6*0,5 = 3 ions sodium propre à la maille.
Soit au total 4 ions sodium par maille.
Le solide étant électriquement neutre, il y a autant d'ion sodium que
d'ion chlorure.
Déterminer
la masse m d'une maille et en déduire la masse volumique µ du chlorure
de sodium.
m = 4(3,84 +5,85 )10-26 =3,88 10-25
kg.
µ = m V =3,88 10-25 /1,76 10-28=2,21 103
kg m-3.
Salinité
de l'eau de la mer Morte.
Méthode d'étalonnage :
la
mer Morte a une concentration de sel telement importante que le corps
humain flotte sans difficulté. On veut déterminer la concentration
en sel de cette eau de mer à partir de sa masse volumique.
Dans cet exercice on assimilera les sels dissous au seul sel " chlorure de sodium".
Une courbe d'étalonnage donnant la masse volumique µ de la
solution en fonction de la concentration molaire C sera tracée à partir
de l'obtention par dissolution de plusieurs solutions aqueuses de
chlorure de sodium de différentes concentrations.
Préparation d'une solution de chlorure de sodium de concentration connue.
Calculer la masse de chlorure de sodium contenue dans V = 200,0 mL d'une solution de concentration C =3,42 mol/L.
n = C V = 3,42 *0,200 = 0,684 mol.
Masse molaire du chlorure de sodium : M = 58,5 g/mol
m = n M = 0,684*58,5 = 40,01 ~ 40,0 g.
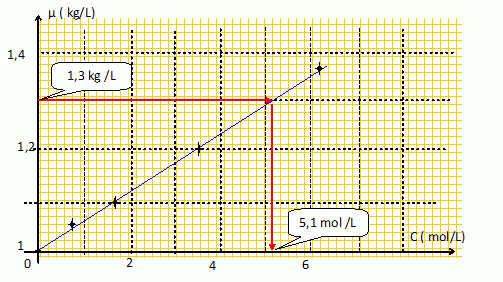
Courbe d'étalonnage.
Différentes solutions ont été réalisées et les données sont regroupées dans le tableau suivant :
numéro de la solution
|
0
|
1
|
2
|
3
|
4
|
concentration molaire ( mol/L)
|
0,00
|
0,85
|
1,71
|
3,42
|
6,15
|
masse volumique µ ( kg / L)
|
1,00
|
1,05
|
1,10
|
1,20
|
1,36
|
Sachant que la masse volumique moyenne de l'eau de la mer Morte est de l'ordre de 1,3 g/mL,
déterminer à l'aide d'une courbe d'étalonnage, la concentration molaire en sel de la mer Morte.
|
La
salinité se mesure classiquement par conductimétrie de l'eau de mer
qui dépend de la quantité de sels dissous. L'unité utilisée est
l'ups " unité pratique de salinité". On admettra l'approximation 1 ups
équivalent à 1 gramme de sel par kilogramme d'eau salée.
Déterminer en unité ups la salinité de cette eau de mer.
Masse de 1 L d'eau de la mer Morte : 1,3 kg.
Masse de sel dans 1 L de cette eau : 5,1*58,5 =298 g
soit 298 / 1,3 =230 ups.
L'océan contient en moyenne 34,7 g de sel par kg d'eau de mer. les eaux
profondes sont relativement homogènes : 90 % d'entre elles ont une
salinité comprise entre 34 et 35 ups. En surface, les variations sont
plus fortes. Les eaux sont plus salées sous les tropiques qu'à
l'équateur et aux hautes latitudes. La salinité est plus élevée dans
l'Atlantique que dans les océans pacifique et Indien.
Proposer une explication simple de l'importante salinité de la mer Morte.
C'est une mer fermée ne recevant pratiquement pas d'eau douce depuis très longtemps.
Elle se trouve dans une région de fort ensoleillement et de température
assez élévée : l'eau s'évapore et la mer s'enrichit en sel.
|
|


