Acide formique.
L'acide formique est soluble dans l'eau ; sa formule semi-développée
est HCOOH.
Cet exercice propose l'étude de quelques propriétés de la solution
aqueuse d'acide formique.
C : 12,0 ; H : 1,00 ; O : 16,0 g/mol ; constante d'acidité Ka
( HCOOH / HCOO-) = 1,80 10-4 ;
lH3O+ = 35,0
mS m2 mol-1 ; lHCOO- = 5,46 mS m2
mol-1.
Quel est le nom de
l'acide formique dans la nomenclature officielle ?
Acide méthanoïque.
On intoduit une masse m d'acide formique dans une fiole jaugée de
volume V = 100 mL ; on complète jusqu'au trait de jauge avec de l'eau
distillée et on homogénéise. On obttient une solution S de
concentration C = 1,00 10-2 mol/L.
Calculer
la masse m.
M= 2+12+32 =46,0 g/mol ; n= CV = 1,00 10-2 *0,100 = 1,00 10-3
mol ; m = n M = 1,00 10-3 *46,0 = 46,0 mg.
Ecrire
l'équation de la réaction de l'acide formique avec l'eau.
HCOOH aq +H2O(l) = H3O+ aq
+ HCOO-aq.
Etablir
le tableau d'avancement relatif à cette réaction.
|
avancement
(mol)
|
HCOOH aq |
+H2O(l)
|
= H3O+
aq |
+ HCOO-aq |
initial
|
0
|
CV = 10-3
mol
|
solvant
|
0
|
0
|
en
cours
|
x
|
10-3
-x
|
en
|
x
|
x
|
final
( si équilibre)
|
xf
|
10-3
-xf |
large
excès
|
xf |
xf |
final
( si réaction totale)
|
xmax
|
10-3
-xmax=0
|
|
xmax |
xmax |
Exprimer
le taux d'avancement final t en fonction de [H3O+ aq]éq et de C.
t =xf / xmax
= [H3O+ aq]éq / C.
|
Donner l'expression
du quotient de réaction à l'équilibre en fonction de [H3O+ aq]éq et de C.
Q
r éq = [H3O+
aq]éq[HCOO- aq]éq / [HCOOH aq]éq
La solution est électriquement neutre : [H3O+ aq]éq= [HCOO- aq]éq ;
Conservation de l'élément carbone : C = [HCOO- aq]éq + [HCOO- aq]éq ;
Q r éq =
[H3O+ aq]éq2
/ ( C-[H3O+ aq]éq).
|
Exprimer la
conductivité s de la
solution d'acide formique à l'état d'équilibre en fonction des
conductivités molaires ioniques et de la concentration des ions oxonium
à l'équilibre.
s = lH3O+ [H3O+ aq]éq +lHCOO- [HCOO- aq]éq = (lH3O+ + lHCOO-)[H3O+ aq]éq.
La mesure de la
conductivité de la solution d'acide formique donne s = 5,00 10-2 S m-1.
Calculer [H3O+
aq]éq, t et Q r éq .
[H3O+ aq]éq = s / (lH3O+ + lHCOO-) = 5,00 10-2 / ((35,0 + 5,46) 10-3)
= 1,236 mol m-3 = 1,24 10-3
mol L-1.
t = 1,24 10-3 / 1,00 10-2 =0,124.
Q r éq =
(1,24
10-3)2/(0,01-1,24 10-3) =1,76 10-4.
Comparer
la valeur de Q r éq avec la valeur de
la constante Ka du couple HCOOH /
HCOO-.
Ces deux valeurs sont pratiquement identiques, l'écart relatif est :
(1,80-1,76) / 1,78 = 2,2 10-2 ( 2,2 %).
Quelle
est l'influence de la concentration de la solution sur le taux
d'avancement et sur le quotient de réaction Q r éq ?
Q r éq =
Ka, il ne dépend que de la température.
t =xf / xmax
= [H3O+ aq]éq / C.
Si la concentration diminue, le taux d'avancement augmente.
Synthèse de
l'aspirine.
En 1825 un pharmacien italien, Francesco Fontana isole le
"principe actif" de l'écorce de saule et le baptise salicine. Par la
suite la salicine donnera de l'acide salicylique, plus efficace, puis
un procédé de synthèse à partir de l'acide salicylique produira l'acide
acéthylsalicylique. C'est la naissance de l'aspirine mise sur le marché
en 1899.
Données :
Masse molaire ( g/mol) : acide salicylique : 138,0 ; anhydride
éthanoïque : 102,0 ; acide acéthylsalicylique : 180,0.
Masse volumique de l'anhydride éthanoïque
r =1,08 g mL-1.
pKa du couple acide acéthylsalicylique / ion
acéthylsalicylate : 3,5 à la température de l'expérience.
L'acide acéthylsalicylique est très peu soluble dans l'eau.
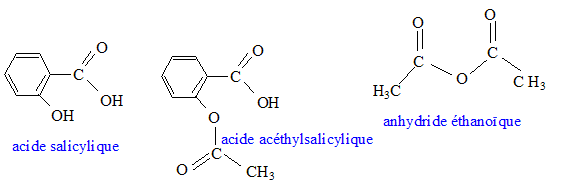
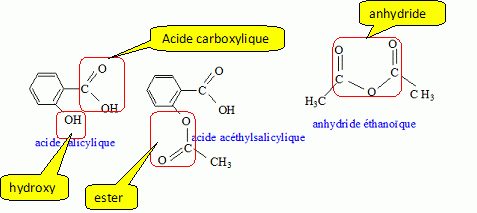
Entourer chaque groupe fonctionnel et le nommer.
Synthèse de l'aspirine au laboratoire.
Dans toute cette partie, on notera R-OH la formule de l'acide salicylique.
Lors d'une séance de TP, un groupe d'élèves propsoe de préparer
l'aspirine en faisant réagir l'acide salicylique sur l'acide éthanoïque
( acétique).
Ecrire l'équation de la réaction. De quel type de réaction s'agit-il ?
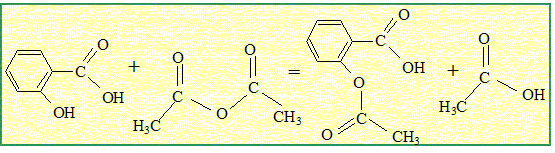
R-OH + CH3-COOH = CH3-COOR + H2O, estérification.
Pourquoi l'avancement maximal ne peut être atteint avec ces deux réactifs ?
L'estérification est limitée par l'hydrolyse de l'ester.
Citer un moyen pour augmenter l'avancement final, en conservant ces deux réactifs.
Mettre l'un des réactifs en excès, ou éliminer par distillation l'un des produits au fur et à mesure qu'il se forme.
|
Après discussion, ce groupe décide de remplacer l'acide éthanoïque par l'anhydride éthanoïque.
Quel est l'intérêt de ce changement ?
Le milieu est anhydre, il n'y a pas d'hydrolyse de l'ester : la réaction est totale.
Ecrire l'équation de la synthèse de l'aspirine à partir de l'acide salicylique et l'anhydride éthanoïque.
 Dans
un ballon bien sec, ce groupe d'élèves introduit : 13,8 g d'acide
salicylique en poudre, 25,0 mL d'anhydride éthanoïque liquide et 10
gouttes d'acide sulfurique concentré. Ils adaptent au ballon un
réfrigérant à boules et chauffent pendant 15 minutes. Après
refroidissement, ils filtrent, rincent et sèchent les cristaux obtenus
: la masse de cristaux est 12,0 g. Dans
un ballon bien sec, ce groupe d'élèves introduit : 13,8 g d'acide
salicylique en poudre, 25,0 mL d'anhydride éthanoïque liquide et 10
gouttes d'acide sulfurique concentré. Ils adaptent au ballon un
réfrigérant à boules et chauffent pendant 15 minutes. Après
refroidissement, ils filtrent, rincent et sèchent les cristaux obtenus
: la masse de cristaux est 12,0 g.
Donner le nom et la formule chimique des ions apportés par l'acide sulfurique. Quel est le rôle du cation ?
H3O+ : oxonium ; HSO4- : hydrogénosulfate ; SO42- : sulfate.
L'ion oxonium joue le rôle de catalyseur.
Calculer la quantité initiale de chaque réactif et vérifier que l'acide salicylique est le réactif limitant.
n (acide salicylique) = m / M = 13,8 / 138 = 0,100 mol.
n( anhydride) = 25,0*1,08 / 102,0 = 0,265 mol ( donc en excès)
Définir le rendement puis le calculer.
rendement = masse expérimentale d'ester / masse théorique.
On peut obtenir au mieux 0,100 mol d'ester soit 0,100 *180,0 = 18,0 g.
rendement = 12,0 / 18,0 = 0,667.
Pour terminer, ce groupe d'élèves dissout totalement les 12,0 g de
cristaux dans de l'eau distillée pour obtenir une solution S. Il dose
ensuite très précisément l'acide acéthylsalicylique contenu dans cette
solution par une solution titrante de soude. Après calcul, ils montrent
que la solution S contient 6,20 10-2 mol d'acide acéthylsalicylique.
Que pouvez-vous en conclure concernant les cristaux ? Justifier par un calcul simple.
Si les cristaux sont purs, ils contiennent 12 / 180 = 6,66 10-2 mol d'acide acéthylsalicylique..
La solution S contient seulement 6,20 10-2 mol d'acide acéthylsalicylique : les cristaux ne sont donc pas purs.
|
|
|
|


