Unités et
symboles :
La liste suivante comporte les symboles d'unités utilisées en physique
chimie :
g, mol, mol L-1, g mol-1, kg m-3, A,
V, Hz, W, S, W, T, Wb, N, J,
m s-1, m s-2, Nm, Pa, °C, J kg-1K-1.
Choisir
dans cette liste le symbole qui convient à l'unité de chaque
grandeur du tableau ci-dessous et le reporter dans la case
correspondante.
intensité
du courant
|
résistance
d'un conducteur
|
puissance
électrique
|
intensité
d'une force
|
moment
d'une force
|
Travail
d'une force
|
A
|
W |
W
|
N
|
N m
|
J
|
masse
molaire
|
quantité
de matière
|
concentration
molaire volumique
|
masse
volumique
|
pression
|
température
absolue
|
| g mol-1 |
mol
|
mol L-1 |
kg m-3 |
Pa
|
K
|
Connaissances
de la classification périodique :
Ciompléter
le tableau ci-dessous :
colonne
de la classification
|
éléments
|
notation
chimique de l'ion correspondant
|
nom
de la famille chimique
|
première
|
11Na
|
Na+
|
alcalins
|
deuxième
|
20Ca |
Ca2+
|
alcalino-terreux
|
avant
dernière
|
17Cl
|
Cl-
|
halogènes
|
Les
composés chimiques :
Compléter
le tableau suivant :
H : 1,0 ; O : 16 ; S : 32 ; C : 12 g/mol ; Vm = 24 L mol-1.
nom
du composé
|
formule
brute
|
état
dans les conditions ordinaires de température et de pression
|
masse
molaire moléculaire
|
masse
m, ou volume V du composé et quantité de matière dans les conditions
ordinaires
|
butane
|
C4H10
|
gaz
|
4*12+10
= 58 g/mol
|
donnée
: V = 6 L
n = V / Vm = 6/24 = 0,25 mol
|
glucose
|
C6H12O6
|
solide
|
6*12+12+6*16
=180 g/mol
|
donnée
: m = 9 g
n = m/M = 9/180 =0,05 mol
|
acide
sulfurique
|
H2SO4
pur
|
liquide
|
2+32+4*16
= 98 g/mol
|
donnée
: n = 0,1 mol
m = n M = 0,1*98 = 9,8 g
|
|
nom
du composé
|
formule
à l'état solide
|
formule
en solution aqueuse
|
sulfate
de sodium
|
Na2SO4
|
2Na+aq
+ SO42-aq
|
dichromate
de potassium
|
K2Cr2O7
|
2K+aq
+Cr2O72-aq
|
chlorure
de fer (III)
|
FeCl3
|
Fe3+aq
+3Cl-aq
|
|
Tests
d'identification de certains composés chimiques :
nom
de l'espèce chimique à identifier
|
réactif
caractéristique
|
résultat
du test
|
ion
chlorure
|
nitrate
d'argent
|
précipité
blanc de chlorure d'argent
|
amidon
|
eau
iodée ou Lugol
|
initialement
jaune, la solution prend une teinte violette noire.
|
glucose
|
liqueur
de Fehling
|
la
solution initialement bleue donne à chaud un précipité rouge
d'oxyde de cuivre (I°
|
acétone
ou propanone
|
DNPH
|
solide
jaune
|
Fonctions
caractéristiques des composés organiques :
nom
de la fonction
|
formule
du groupement fonctionnel
|
nom
d'un composé organique comportant le groupement fonctionnel
|
alcool
primaire
|
-CH2OH
|
alcool
éthylique ou éthanol
|
acide
carboxylique
|
-COOH
|
acide
éthanoïque ou acétique
|
ester
|
- COO-C
|
&thanoate
de butyle
|
aldehyde
|
-CHO
|
éthanal
|
amine
primaire
|
-NH2
|
éthylamine
|
La
verrerie :
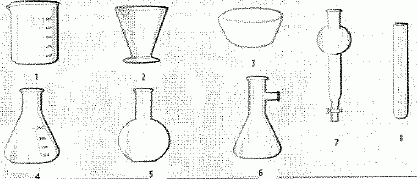
1 : becher ; 2 : verre à pied ; 3 : coupelle ; 4 : erlenmeyer ; 5
: ballon à fond plat ; 6 : fiole à vide ; 7 : ampoule
à décanter ; 8 : tube à essais.
9 : pipette ; 10 : pipette graduée ; 11 : pipette jaugée ; 11 :
éprouvette ; 12 fiole jaugée ; 13 : burette graduée.
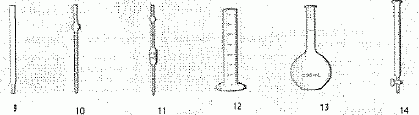
Nommer
les éléments numérotés
|
1
:élévateur à croisillons
2 :chauffe ballon électrique
3 : réfrigérant à eau
|
préciser
le rôle de l'élément 1
|
monter
ou descendre le ballon et chauffe ballon
|
indiquer
dans quel sens doit circuler l'eau de refroidissement
|
de B
vers A
|
le
distillat comporte deux phases : les identifier et indiquer dans
laquelle se trouve l'arôme extrait
|
la
phase aqueuse la plus dense est en bas ; la phase organique est au
dessus : elle contient l'arôme.
|
Donner
le nom de ce mode d'extraction
|
hydrodistillation
|
Les
arômes des zestes d'orange peuvent être extraits par le cyclohexane.
Donner le nom de cet autre mode d'extraction.
|
extraction
par solvant dans une ampoule à décanter.
|
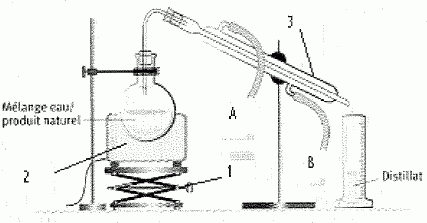
Dosage :
Indiquer
l'objectif de ce dosage
|
Déterminer
la concentration inconnue de la solution titrée
|
Donner
la formule des ions présents dans la solution titrante.
|
la
solution titrante est dans la burette : Na+ aq et Cl-
aq
|
Ecrire
l'équation de la réaction de dosage
|
Cl-
aq +Ag+aq = AgCl(s)
|
Donner
le nom de ce type de dosage.
|
Dosage
par précipitation, suivi conductimétrique
|
Indiquer
comment on repère le passage à l'équivalence
|
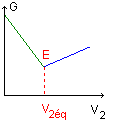
|
Méthode
de purification :
Afin de purifier un produit sous forme de cristaux, on lui ajoute un
solvant approprié, puis on réalise les 4 opérations ci-dessous :
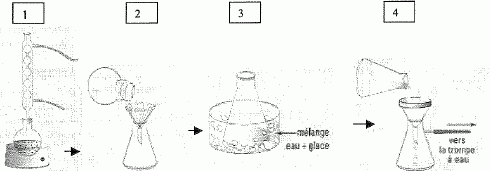
Donner
un nom à chacune des opérations 1, 2, 3 et 4 :
|
1
: dissolution du solide à chaud dans le minimum de solvant
2 : filtration ; 3 : cristallisation du solide à froid
4 : filtration sous vide du solide pur cristallisé.
|
Indiquer
l'observation qui marque la fin de l'opération 1
|
le
solide doit être totalement dissout à chaud
|
Lors
de l'opération 4 il est recommandé de monter une fiole de garde avant
la trompe à eau. Expliquer son rôle.
|
On
désire conserver le filtrat.
La fiole de garde d'empêche le retour de l'eau dans la fiole à
vide, par suite des variations de la pression provoquées par un débit
d'eau irrégulier.
|
Dire
avec quel appareil on peut évaluer la pureté du produit obtenu à partir
de la température de fusion
|
banc
Kofler
|
Chromatographie.
Dans le soda " ligth" les sucres sont remplacés par de l'aspartame.
Afin de vérifier que ce soda ne renferme pas de sucre, on réalise une
chromatographie dont les principales étapes sont schématisées
ci-dessous :
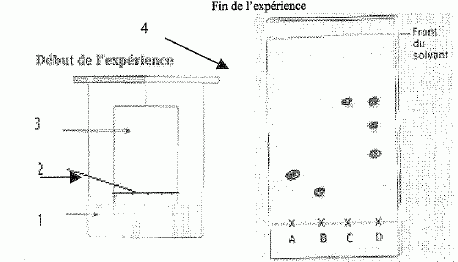
A : glucose, B : saccharose, C : aspartame, D : soda.
Nommer
les éléments numérotés de 1 à 4
|
1
: éluant, phase mobile
2 : ligne des dépôts
3 : support fixe, plaque recouverte de silice par exemple
4 : chromatogramme après révélation
|
Dire
combien il y a de constituants dans le soda testé et identifier lequel
on peut identifier.
|
3
taches visibles donc 3 constituants ; on identifie C,
l'aspartame, même rapport frontal.
|
Diverses
techniques permettent de révéler le résultat final de la
chromatographie.
|
utiliser
un révélateur qui après réaction chimique conduit à des
substances colorées.
Exposer sous lampe UV.
|
|
Titrage
pHmétrique d'une solution acide.
Le titrage est celui
d'un volume Va = 20,0 mL d'une solution acide par une
solution de soude de concentration CB=0,10 mol/L.
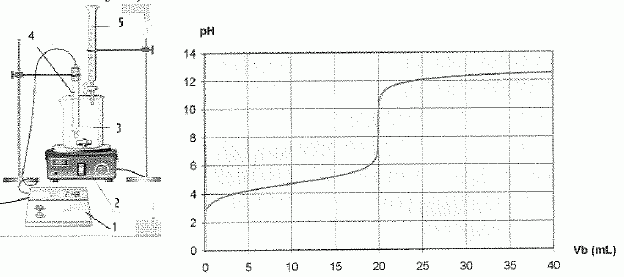
Nommer
les éléments 1 à 5
|
1
: pHmètre ; 2 : agitateur magnétique
3 :bécher : solution titrée (acide); 4 : électrode de mesure
5 : burette graduée : solution titrante (soude)
|
Dire
quelle opération préalable doit être effectuée sur l'élément 1
|
étalonnage
du pHmètre avec deux solutions étalon de pH connu.
|
Lors
de la mise en place de la solution titrante, 2 opérations techniques
sont nécessaires. Les citer.
|
Le
robinet de la burette doit être fermé.
La burette doit être remplie jusqu'au "zéro" de la graduation.
|
Préciser
avec quel instrument la prise d'esai de la solution acide doit être
effectuée.
|
Pipette
jaugée de 20,0 mL + dispositif d'aspiration ( poire ou pipeteur )
|
Déterminer
les coordonnées du point d'équivalence.
|
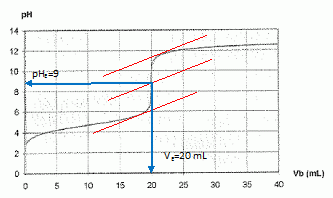
|
En
déduire la concentration C de la solution acide
|
A
l'équivalence : CVa = CBVE ;
C = CBVE /Va = 0,10 *20 /20 = 0,10
mol/L |
Donner
la valeur du pH de la solution acide avant dosage et en déduire la
concentration initiale en ion oxonium H3O+aq.
|
Le
pH initial ( pour Vb=0) est voisin de pH=3.
[H3O+aq] = 10-pH = 10-3
mol/L.
|
Dire
en justifiant si l'acide est fort ou faible.
|
L'acide
est faible : le pH à l'équivalence est différent de 7 ; le pH
initial est supérieur à -log C.
|
On
veut repérer l'équivalence à l'aide d'un indicateur coloré.
Indiquer celui qui convient le mieux pour ce type de titrage.
|
la
zone de virage de l'indicateur coloré doit contenir le pH du point
équivalent : phénolphtaléine.
|
Lecture
d'étiquette.
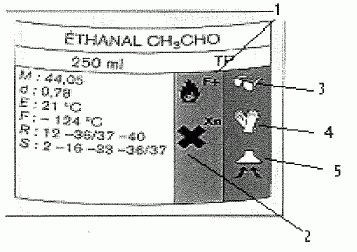
Donner
la signification des lettres M, d, E et F
|
M
: masse molaire g/mol ; d : densité par rapport à l'eau
E : température ébullition sous 1 bar ; F : température de fusion du
solide sous 1 bar
|
Calculer
la masse d'éthanal contenue dans le flacon.
|
m
= 250*0,78 = 195 g
|
Calculer
la quantité de matière correspondante.
|
n
=m/M = 195 / 44,05 =4,43 mol.
|
Donner
la signification exacte des 5 pictogrammes numérotés de 1 à 5.
|
1
: très inflammable ; 2 : toxique
3 : port obligatoire de lunette
4 : port obligatoire de gants
5 : travailler sous hotte aspirante.
|
|
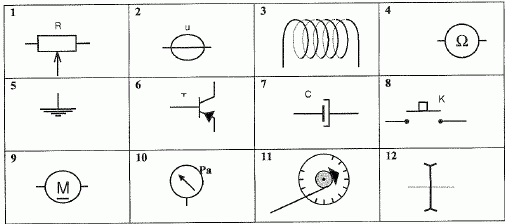
1 : rhéostat : 2 : générateur de tension ; 3 : bobine inductive (
inductance) ; 4 : ohmmètre ; 5 : mise à la terre : 6 : transistor
PNP; 7 : condensateur chimique ; 8 : interrupteur
9 : moteur ; 10 : manomètre ; 11 : dynamomètre ; 12 : lentille divergente.
Caractéristiques de tensions alternatives.
On visualise sur l'écran de l'oscilloscope deux tensions alternatives u1 ( voie A ) et u2 ( voie B)
Voie A : 2 V / div ; voie B : 1 V / div ; balayage : 1 ms / div.
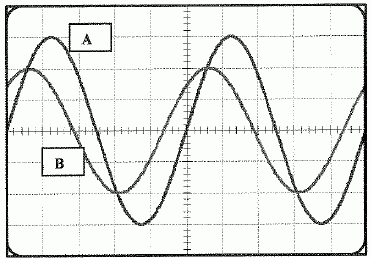
Qualifier plus précisément les deux tensions
|
tensions alternatives sinusoïdales périodiques
|
Déterminer leur période T et leur fréquence f.
|
T correspond à 5 divisions soit 5 ms
T = 5 10-3 s ; f = 1/T = 1/5 10-3 = 200 Hz.
|
Déterminer les valeurs des tensions maximales.
|
U1max : 3 div soit 6 V
U2max : 2 div soit 2 V
|
Déterminer les valeurs des tensions efficaces
|
U1eff = 6 / 2½ = 4,2 V
U2eff = 2 / 2½ = 1,4 V |
Comment peut-on mesurer les tensions efficaces ?
|
Voltmètre ( multimètre ) monté en dérivation utilisé sur la position AC.
|
Déterminer le déphasage entre u1 et u2.
|
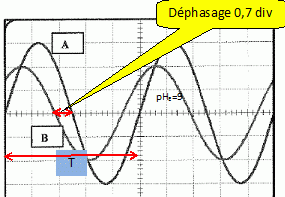
Quand les deux tensions varient dans le même sens, celle sui est en avance passe la première par un maximum : u2 est en avance sur u1 de 0,7 division.
Une période correspond à 5 divisions et à 2 pi radians :
déphasage : 0,7*2 pi / 5 = 0,88 rad ( 50°)
|
|












