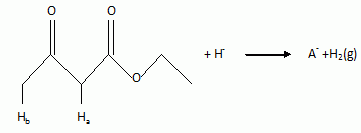L'acétoacétate
d'éthyle ou 3 oxobutanoate d'éthyle est un ß cétoester que l'on notera
A. Il est synthétisé par condensation de deux molécules d'acétate
d'éthyle en présence d'une base forte.
Alkylation
sélective.
En solution dans le tétrahydrofurane anhydre ( THF), le cétoester A est
traité par de l'hydrure de sodium (Na+ H-) pour
donner un monoanion A- selon :
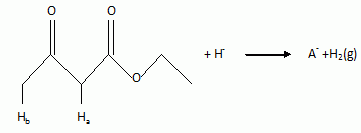
Indiquer
la raison pour laquelle le solvant doit être anhydre.
L'ion hydrure H- réagit avec l'eau.
Comment
peut-on maintenir anhydre le THF ?
Utiliser un agent désséchant ( MgSO4 anhydre) ; faire passer
lentement le solvant sur un tamis moléculaire.
Montrer
que les atomes Ha et Hb sont particulièrement
acide.
Ces atomes d'hydrogène se trouve en a
d'un carbonyle ; l'ion résultant de leur départ est stabilisé par
résonance.
Ha est situé entre deux carbonyles ; la charge de l'ion
résultant du départ de Ha est répartie sur un plus grand
nombre d'atomes que pour le proton Hb.
Ha est plus acide que Hb,
d'où l'ion A- :
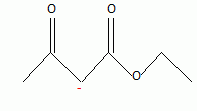
A
la solution du monoanion A- on ajoute goutte à goutte, à
température ambiante, une solution de 1-iodobutane dans le THF anhydre.
Après réaction puis neutralisation on isole un composé B de formule
brute C10H18O3.
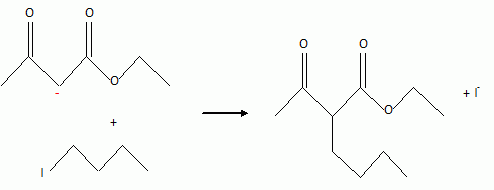
L'ion A-, nucléophile, riche en électrons attaque une
molécule électrophile ; I- est le groupe partant ou
nucléofuge.
Il s'agit d'une substitution nucléophile.
|
Chromatographie
sur couche mince. ( CCM)
La CCM du 3-oxobutanoate d'éthyle commercial et du composé B en
solution à 1 % dans la propanone est réalisée. L'éluant est un mélange
pentane- diéthyléther.
Rappeler
le principe d'une chromatographie sur couche mince.
C'est une
méthode physique de séparation et d'identification des constituants
d'un mélange ; elle utilise
les différences d’affinité d'une espèce à l’égard de deux phases,
l’une fixe, l’autre mobile.
La phase fixe solide est fixée sur une plaque ; la phase mobile
liquide, nommée éluant, est un un mélange de solvants.
Indiquer
les différentes étapes de la réalisation.
|
Préparation
de la cuve : verser l'éluant
jusqu'à 1cm de hauteur environ au fond d'un grand bécher. Couvrir.
Préparation de la plaque
:
tracer au crayon à papier une ligne à un peu plus de 1cm du bas de la
plaque . Marquer au crayon sur cette ligne (ligne des dépots) les emplacements où l'on
déposera les solutions à analyser. Les emplacements doivent être
distants d'environ 1cm, et à au moins 1cm des bords.
Dépôt de l'échantillon :
A l'aide d'une pipette
pasteur, ou d'un tube capillaire, déposer une goutte sur la plaque à
l'emplacement marqué. Laisser sécher. Si la solution est trop diluée,
on peut faire plusieurs dépôts au même emplacement , à condition de
bien sécher la plaque entre deux gouttes.
Développement du
chromatogramme :
Lorsque les dépôts sont secs, placer la plaque le plus verticalement
possible dans la cuve, ligne de dépôt vers le bas. La surface de
l'éluant doit être en
bas de cette ligne. Couvrir. Surveiller la plaque régulièrement : quand
l'éluant est à environ 1cm du bord supérieur, sortir la plaque, marquer
le niveau atteint par le solvant au crayon à papier, sécher la plaque.
Révélation
:
Si les taches sont incolores, on les fera apparaître sous une lampe UV
ou à l'aide d'un révélateur
chimique.
Par exemple les fonctions alcool des sucres réduisent le permangante de
potassium qui vire au jaune.
La
phase mobile migre de bas en haut, par capillarité, sur la phase fixe,
entraînant les constituants du mélange. Cette élution permet la
séparation des constituants du mélange.
Chaque constituant migre d’une certaine hauteur, que l’on appelle
rapport frontal (Rf), caractéristique d'une espèce
pour un éluant donné.
Réduction
sélective.
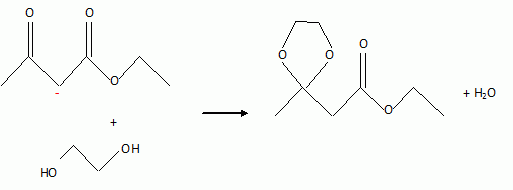
Dans
un ballon on mélange 100 mmol de composé A, 110 mmol d'éthan1,2-diol,
50 mL de toluène et 0,5 g de paratoluène sulfonique (
catalyseur). On adapte le ballon au Dean Stark. Le mélange est chauffé
à reflux jusqu'à ce que le niveau de l'eau dans le Dean Stark soit
constant. Au cours de cette réaction, l'eau et le toluène sont les
seuls composés volatils. Ils forment un hétéroazéotrope de température
84°C et de fraction molaire en eau de 0,45 sous la pression
atmosphérique. A l'état liquide, ils sont non miscibles.
L'équation de la réaction est :
Après réaction la
phase organique est neutralisée, lavée puis séchée sur sulfate de
magnésium solide. Après évaporation du solvant, on obtient 15,1 g de
composé C solide.
Calculer
le rendement de la réaction.
Masse molaire de C ( C8H14O4 ): M =
8*12+14+4*16 =174 g/mol
n= m/M = 15,1 / 174 = 0,0868 mol = 86,8 mmol.
Rendement : quantité de matière réelle / quantité de matière théorique
= 86,8 / 100 = 0,868 ( 86,8 %).
Le but d'un appareil
de Dean-Stark est d’enlever l’eau du milieu. Pour cela, on ajoute un
solvant afin de former avec l’eau un hétéroazéotrope dont la
température d’ébullition sera la plus faible de tous les composés
présents.
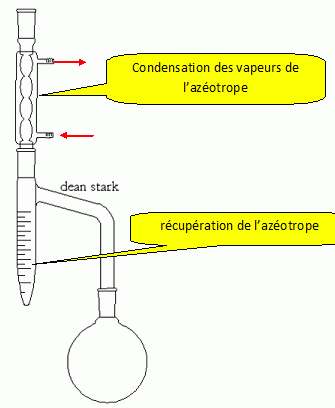
On peut également réaliser une estérification à l'aide de ce type de
montage : l'eau étant enlevée du milieu réactionnel, l'équilibre est
déplacé dans le sens direct.
|
On réalise maintenant
une réduction sélective de la fonction ester de C par l'hydrure de
lithium et d'aluminium LiAlH4 en solution dans le THF
anhydre. Après réduction, le mélange est hydrolysé en présence d'une
solution aqueuse d'acide sulfurique.
Après extraction et purification on isole un composé D dont la formule
topologique est :
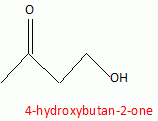
Intérêt d'avoir réalisé l'étape précédente : protection du
carbonyle de la cétone.
|