Chimie organique (4/20).
Erire la formule semi-développée des composés suivants :
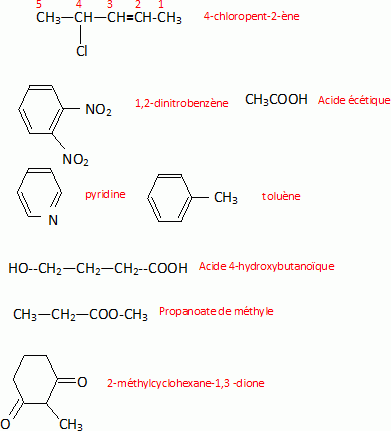
Classer ces solvants par ordre de polarité croissante et indiquer ceux qui ne sont pas miscibles à l'eau.
Pentane ; dichlorométhane ; méthanol ; acétonitrile ; eau.
Le dichlorométhane et le pentane ne sont pas miscibles à l'eau.
|
Chimie générale ( 2/20 ) :
A quelle puissance de 10 correspondent les sous-multiples suivants ?
nano
|
atto
|
milli
|
femto
|
micro
|
pico
|
10-9
|
10-18 |
10-3 |
10-15 |
10-6 |
10-12 |
|
Vous disposez de 250 mL d'une solution concentrée à 30 %.
Quel sera le volume final de cette solution si vous la diluer pour obtenir une concentration à 25 % ?
Facteur de dilution : F = 30 / 25 =1,2 ; volume final = 250*1,2 = 300 mL.
Si on triple le volume d'une solution, que fait la concentration ?
- elle est le triple de la concentration initiale
- elle est le tiers de la concentration initiale
- elle est le triple du volume final
- elle est le tiers du volume final.
Vous ajoutez 350 mL de solvant dans 250 mL d'une solution à 0,15 g/L.
Quelle sera la nouvelle concentration de cette solution en mg/L ?
Facteur de dilution F = volume total final / volume initial de la solution = (350+250) / 250 =2,4.
Nouvelle concentration après dilution : 0,15 / 2,4 = 0,0625 g/L = 62,5 mg/L.
Spectrométrie de masse ( 6 /20 ).
Quelle est la grandeur physique mesurée en spectrométrie de masse ? Quelle est son unité ?
L'analyseur sépare les ions en fonction du rapport masse / charge ( m / q).
m est la mase en unité de masse atomique et e
la charge électrique exprimée en nombre de charge élémentaire.
m/z s'exprime en g/mol ou en Dalton ( Da) dans le cas des protéines.
Quelle est la signification des sigles ( français ou anglais ) suivant ?
MALDI-MS : Matrix Assisted Laser Désorption Ionisation - spectrométrie de masse.
ESI-MS : electrospray ionisation-mass spectrometry.
GC-MS : Gas chromatography-mass spectrometry.
APCI : ionisation chimique à pression atmosphérique.
EI : electron ionisation ( ionisation forte.
CI : chemical ionisation ( ionisation douce ).
LC-MS : Liquid chromatography-mass spectrometry.
Citer dans l'ordre les 4 parties principales que comporte un spectromètre de masse.
Source d'ion : production d'ions en phase gazeuse.
Analyseur m / z : séparation des ions produits en fonction du rapport masse / charge ( m / z).
Détection : conversion d'un courant ionique en courant électrique.
Traitement du signal : représentation des données sous forme d'un spectre de masse.
Indiquer
quelle partie du spectre de masse se trouve sous vide secondaire. Quel
est l'ordre de grandeur de la pression correspondante ( exprimée en mbar )
L'analyseur se trouve sous vide secondaire ; le vide secondaire ( 1 à 10-7 hPa ou mbar ) est obtenu à l'aide de pompe
turbomoléculaire, de pompe à diffusion d’huile.
Citer un type de pompe permettant d'obtenir un vide primaire.
Le vide prrimaire ( 1000 à 1 hPa) est obtenu à l'aide de pompe à
palettes.
QCM. ( les bonnes réponses sont écrites en rouge
et soulignées )
- en ionisation MALDI, l'échantillon est irradié par un faisceau laser.
- les ions sont produits dans l'analyseur du spectromètre de masse.
- les ions sont séparés en phase liquide.
- seuls les ions chargés positivement peuvent être analysés en MALDI.
- Dans un analyseur à temps de vol, les ions de rapport m/z le plus petit arriveront au détecteur les premiers.
- un analyseur de type temps de vol ne peut pas être couplé à une source d'ionisation électrospray.
- Le courant d'ion est transformé en courant électrique.
En ionisation ESI un composé de masse 1000 peut apparaître sous forme d'un pic dont l'abscisse est 501.
- Plusieurs analyseurs peuvent être couplés entre eux.
- Une solution d'un composé de concentration 10-6 mol/L peut être analysée en ESI.
A quelle notion est reliée la formule mathématique M / DM ( où M est la masse mesurée d'un composé et DM la largeur à mi-hauteur du pic de masse mesuré ?
Le pouvoir de résolution.
Quelle est la différence entre masse monoisotopique et masse moyenne ?
Masse mono-isotopique : c'est la masse d'une molécule composée seulement d'isotopes
les plus stables.
Masse moyenne : c'est la masse molaire moyenne pour tous les isotopes d'un élément
donné.
Deux composés de formules brutes C17H18N2O7 et C17H13NO6Cl sont analysés par spectrométrie de masse. Les deux spectres présentent un pic moléculaire à m/z = 349.
Quelle différence entre les deux spectres MS permet d'associer chaque spectre à un composé ?
3517Cl : 75% et 3717Cl : 25 %. C17H13NO6Cl doit présenter un pic moléculaire à M+2 très important.
Interprèter les pics à m/z 51, 77, 105 et 121 du spectre d'impact électronique de la benzamide.
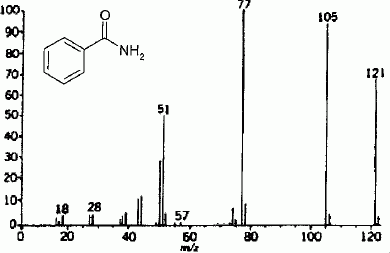
Pic à 77 : noyau benzénique C6H5+ ; pic à 105 : C6H5CO+ ; pic à 121 moléculaire : C6H5CONH2+ ; pic à 51 : C4H3+.
Choisir le type d'ionisation ( IE ou ESI) pour une analyse directe et sans traitement chimique des molécules suivantes :
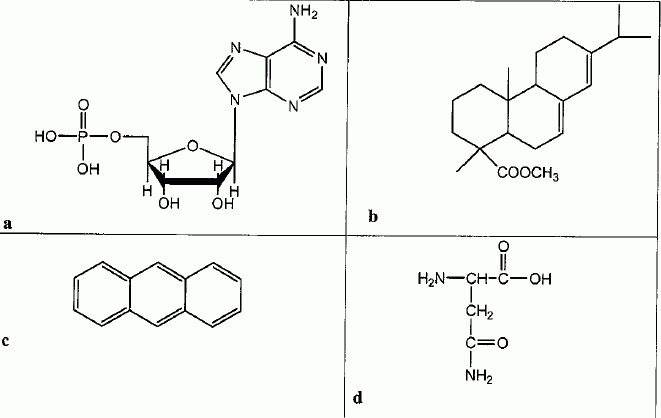
L'avantage de l'ionisation douce ESI est l'obtention d'ions multichargés et multiprotonés
qui permettent la détermination de molécules très lourdes ( a et b).
c) est un système conjugué très stable : il faut dépenser beaucoup d'énergie pour en extraire un électron ( IE).
d) l'ion NH2CO+ est stabilisé par résonance, il sera facile à former ( ESI).
|
Chromatographie.(2/20 )
En chromatographie, la grandeur expérimentale caractéristique est le temps de rétention.
Parmi les paramètres proposés ci-dessous, lesquels ont une influence sur cette grandeur ?
Débit phase mobile ; quantité injectée ; type de détecteur ; composition phase mobile.
Parmi cette liste de détecteus, lesquels sont compatibles avec l'analyse HPLC ?
UV ; fluorimétrie; ionisation de flamme ; réfractométrie ; capture d'électrons.
Lorsqu'on
fait varier au cours d'une analyse chromatographique les proportions
des différents solvants constituant la phase mobile, on dit qu'on opère
en mode :
isocratique ; gradient ; isotherme.
Lors d'une analyse chromatographique, quelle est la polarité de la phase stationnaire lorsqu'on travaille :
a) phase inverse ( apolaire) ; phase normale ( polaire )..
Un mélange de 5 composés est analysé par LC-MS sur un système HPLC
pourvu d'une colonne à polarité de phase inversée, couplé à un
spectrophotomètre de masse de type ESI-tof. Les masses moléculaires
théoriques des 5 composés sont 129, 267, 330, 332, 568 g/mol. Le
chromatogramme obtenu présente 2 pics fins et symétriques aux temps de
rétention t1 = 5 min et t2 = 13 min et un pic large avec un épaulement au temps de rétention t3 = 22 min. Le spectre de masse correspondant au temps de rétention t3 comporte 3 pics aux abscisses m/z 129, 330 et 332.
Que dois-je faire ?
- Je change de spectrophotomètre de masse et j'utilise une source d'ionisation MALDI.
- J'utilise un spectromètre de masse avec un analyseur différent.
- J'essaie d'améliorer la séparation par chromatographie en changeant le gradient.
- J"ai un problème de sensibilité, donc je nettoie la source.
Sécurité.(2/20 )
Répondre vrai ou faux.
- L'eau désionisée est impropre à la consommation. Faux.
Elle ne possède aucun goût.
- Le port des équipements de protections individuels n'est obligatoire qu'en cas d'utilisation d'acide fort ou de base forte. Faux.
- Le port de lunettes de protection n'est pas obligatoire si on porte des lunettes de vue. Faux.
- Après un nettoyage à l'acide nitrique, je peux directement rincer mon échantillon à l'acétone. Faux.
L'acétone est oxydé par l'acide nitrique. Cette réaction est
exothermique.
Quels sont les VPI ( vêtement de protection individuel ) ? 3 réponses minimum.
Gants, lunettes, chaussures de sécurité, blouses, bleu de travail, casque.
Quelles précautions prendriez-vous pour préparer une solution diluée d'acide sulfurique à partir d'acide concentré ?
Port de lunettes, gants de protection et blouse.
Identifier les pictogrammes.

Dans l'ordre : irritant, nocif ; protection obligatoire des yeux ;
exctincteur ; matières radioactives ; champ magnétique important.
|



