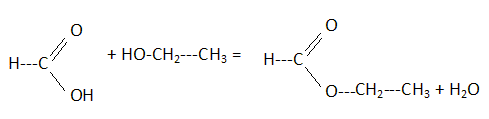Le
composé E, ester dont la formule semi-développée est donnée ci-dessous,
est utilisé dans l’industrie alimentaire en tant qu’additif aromatique.

Donner le
nom systématique de l’ester E.
méthanoate d'éthyle.
Pour synthétiser E, on fait réagir entre elles deux molécules : A, qui
appartient à la famille des acides carboxyliques et B, à celle des
alcools.
Ecrire
l’équation-bilan de la réaction en faisant apparaitre les formules
semi-développées des réactifs et produits.
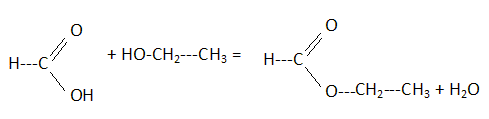
L’expérience est menée en mélangeant nA0 = 0,50
mol de A avec nB0 = 1,00 mol de B, auxquels on
additionne quelques gouttes d’acide sulfurique concentré. Le mélange
est porté à reflux dans un réacteur fermé, à volume constant. La
réaction est athermique.
Quel
volume de A a-t-on mesuré pour réaliser l’expérience ?
ρ(A) = 1,22 g.cm-3 , ρ (B) = 0,79 g.cm-3
.
Masse molaire de A : M(A) = 12+2+32 = 46 g/mol
masse de A : m = nA0 M(A)
= 0,50*46 = 23 g
Volume = m / ρ(A)
= 23 / 1,22 = 18,86 ~19 mL.
|
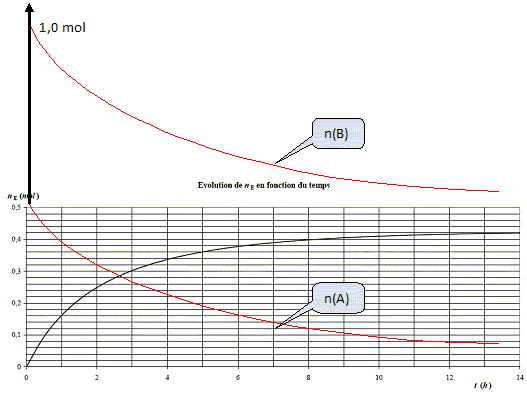
On
étudie l’évolution de la concentration du produit E (quantité nE
mesurée en mol) à partir de l’instant où le mélange est réalisé.
On
peut assimiler la vitesse initiale à la vitesse moyenne de la réaction
pendant la 1ère heure. Déterminer
cette vitesse.
|
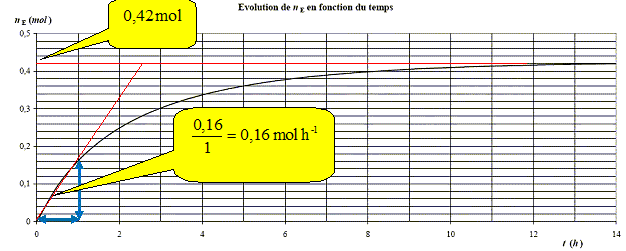
On considère qu’après 14 h
le système n’évolue plus. Déterminer
l’avancement final et le taux d’avancement de la réaction.
Avancement final xf =0,42 mol ; avancement
maximal : xmax = 0,50 mol.
Taux d'avancement final : xf / xmax
= 0,42/0,5 = 0,84.
Déterminer
le temps de demi-réaction.
Durée au bout de laquelle l'avancement est égal à la moitié de
l'avancement final
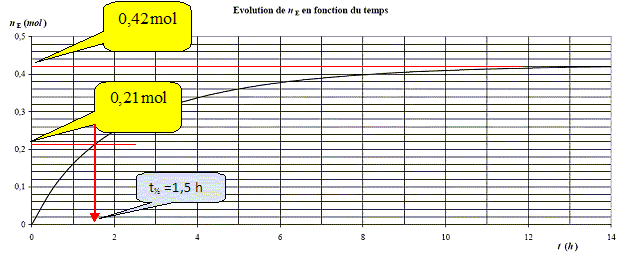
Tracer sur
la courbe l’évolution des quantités des réactifs.
Donner
la constante d’équilibre de la réaction.
K = [ester]éq [eau]éq /
([acide]éq [alcool]éq).
K =0,42 *0,42 /(0,08*0,58) =3,8.
Indiquer
parmi les modifications de protocole proposées celle(s) qui
permettent d’augmenter la quantité d’ester formée à la fin de
l’opération.
- augmenter la température ; faux
;
- augmenter le temps de réaction ; faux
;
- diminuer la température ; faux
;
- doubler la quantité de A ; vrai ;
- ajouter plus de catalyseur ; faux
;
- doubler la quantité de B ; vrai.
|