Etude d'un sel alcalin Kx[Fey(C2O4)z].tH2O
On
souhaite synthétiser et déterminer la
formule exacte de ce complexe alcalin. Pour cela, on dissout m1 = 11,0
g d'oxalate de potassium monohydraté (K2C2O4.H2O)
dans 15 mL d'eau distillée et on porte le mélange à ébullition. Pendant
l'ébullition, on ajoute au milieu une solution préparée à partir d'une
masse m2 = 3,2
g de chlorure de fer(III) anhydre dissoute dans 10 mL d'eau. Après
refroidissement, filtration et séchage, on obtient une masse m3
= 7,63 g de cristaux verts.
On
introduit 110 mg de solide dans un
erlenmeyer de 250 mL. On ajoute également environ 20 mL d'eau
déminéralisée et
15 mL d'acide sulfurique à 20% (V/V).
On effectue un dosage colorimétrique
à l'aide d'une solution de permanganate de potassium notée (S) de
concentration
CS = 0,020 mol.L-1.
On obtient un volume équivalent V1 =
13,95 mL. Le dosage est arrêté juste après le volume
équivalent : on
ajoute alors dans le milieu réactionnel 600 mg de poudre de zinc. On
laisse
sous agitation magnétique pendant environ 15 minutes. La solution
obtenue est
alors filtrée et rincée. Le filtrat est récupéré et acidifié par 8 mL
d'acide
sulfurique à 20% (V/V) et 5 mL d'acide
phosphorique à 85% (V/V).
Le milieu est alors dosé par une seconde solution de permanganate de
sodium,
notée (S'), de concentration CS' =
0,004 mol.L-1. Le volume équivalent obtenu est V2
= 11,60 mL.
Ecrire l'équation de
dissolution du complexe en milieu acide.
Kx[Fey (C2O4)z]
+ 2H+aq= x K+ aq + y Fe3+ aq + zH2C2O4
aq
Ecrire l'équation du
premier titrage. Exprimer et calculer sa constante thermodynamique
d’équilibre K° à 298 K.
réduction
de l'ion permanganate :
2 fois
{
MnO4-
+ 8H+ + 5e- --> Mn2+ + 4
H2O}
oxydation de
l'acide oxalique :
5 fois {
H2C2O4 --> 2
CO2 + 2H+
+ 2e- }
2MnO4-
+ 6H+ + 5
H2C2O4
--> 10 CO2 + 2Mn2+
+ 8 H2O.
K = [CO2]10[Mn2+]2 / ( [MnO4-
]2[H+]6[H2C2O4]5)
E1 =E°(CO2 /H2C2O4)+ 0,006 log ([CO2]10 [H+]10 /[H2C2O4]5)
E2 =E°(MnO4- /Mn2+ ) +0,006 log ([MnO4-
]2[H+]16 /[Mn2+]2 )
A l'équilibre : E1 =E2 ; -0,49 +0,006 log ([CO2]10 [H+]10 /[H2C2O4]5) = 1,51 +0,006 log ([MnO4-
]2[H+]16 /[Mn2+]2 )
1,51 +0,49 = 0,006 log [CO2]10[Mn2+]2 / ( [MnO4-
]2[H+]6[H2C2O4]5)
2,0 = 0,006 log K ; log K = 333,3 ; K = 2,2 10333.
Comment
repère-t-on l'équivalence ?
L'ion permanganate est la seule espèce colorée ( violet).
Avant l'équivalence, MnO4-
est en défaut dans l'erlenmeyer ( solution incolore ) ; après l'équivalence, MnO4-
est en excès dans l'erlenmeyer ( solution rose violette ).
|
Lors
de ce titrage, il est nécessaire de chauffer le milieu réactionnel en
début de titrage, ce qui n'est plus le cas en fin de titrage. Proposez une
explication à ce phénomène.
L'ion Mn2+, un produit de la réaction, joue le rôle de catalyseur. ( autocatalyse ).
Calculer la quantité de matière
ainsi que la masse d'ions oxalates contenus dans l'échantillon analysé. En
déduire le pourcentage massique d'ions oxalate.
à l'équivalence :
quantité de matière d'ion permanganate : CSV1 =0,02 * 13,95 10-3 =2,79 10-4 mol.
quantité de matière d'acide oxalique : 2,5 *2,79 10-4 = 6,975 10-4 mol.
masse molaire de l'ion oxalate : M = 2*12+4*16 = 88 g/mol
masse d'ion oxalate : 88*6,975 10-4 =6,138 10-2 g ~ 6,14 0-2 g = 61,4 mg
soit 61,4 / 110 = 0,558 ( 55,8 %).
|
Quel est l'intérêt de l'ajout de
zinc ? Donner l'équation de la réaction.
Le zinc est un réducteur ; il réduit les ions fer(II) en ion fer (II).
Zn(s) + 2Fe3+aq = Zn2+aq + 2Fe2+aq
Ecrire la réaction du second
titrage.
MnO4- + 8
H+ + 5 e- = Mn2+ +
4H2O
réduction.
Fe2+ = Fe3+ +
e-
oxydation.
MnO4- + 8
H+ + 5 Fe2+ --> Mn2+ +
5Fe3+ +4H2O
Pourquoi se met-on en milieu acide?
Quel est le rôle particulier de l'acide phosphorique dans ce cas ?
L'ion oxonium est un réactif ; l'ion permanganate est oxydant en milieu acide : son pouvoir oxydant diminue si le pH augmente.
L'acide phosphorique précipite les ions zinc ( issus de l'oxydation de la poudre de zinc ) en phosphate de zinc insoluble.
Calculer la quantité de matière
ainsi que la masse d'ions fer(III) contenus dans l'échantillon analysé. En
déduire le pourcentage massique d'ions fer.
à l'équivalence :
quantité de matière d'ion permanganate : CS'V2 =0,004 * 11,60 10-3 =4,64 10-5 mol.
quantité de matière d'ion fer II : 5 *4,64 10-5 = 2,32 10-4 mol.
masse d'ion fer III : 55,85*2,32 10-4 =1,296 10-2 g ~ 1,30 10-2 g = 13,0 mg
soit 13,0 / 110 = 0,118 ( 11,8 %).
Calculer le
rapport entre la quantité de matière d'oxalate et la quantité de matière
de fer dans le complexe.
2,32 10-4 mol d'ion fer III et 6,975 10-4 mol d'ion oxalate.
1 ion fer III pour 3 ions oxalate.
En déduire
x, y et z dans la formule du complexe. Nommer ce complexe en nomenclature systématique.
Kx[Fey (C2O4)z]
+ 2H+aq= x K+ aq + 1 Fe3+ aq + 3H2C2O4
aq
La conservation de la charge conduit à x = 3.
K3[Fe (C2O4)3]
trioxalatoferrate III de potassium dihydrate.
Donner une
représentation dans l'espace de la partie anionique de ce complexe. Cette
structure est-elle chirale ?
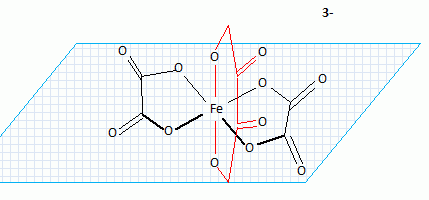
Structure pyramidale à base carrée : il existe plusieurs plan de symérie : l'anion n'est pas chiral.
Calculer la masse de potassium
présente dans l'échantillon et en déduire la masse d'eau contenue dans
l'échantillon. Déterminer alors t et donner la formule complète du
complexe.
6,975 10-4 mol d'ion oxalate, donc d'ion potassium soit en masse : 39,1 *6,975 10-4 =0,0273 g = 27,3 mg.
Masse d'eau : 110-27,3-13,0 -61,4 = 8,3 mg.
quantité de matière d'eau : 8,3 10-3 / 18 =4,61 10-4 mol soit 2* 2,32 10-4 mol
K3[Fe(C2O4)3].2H2O
Calculer le rendement de la synthèse.
Le rendement se calcule par rapport au réactif en défaut.
3,2 g FeCl3 soit : 3,2 / (55,85+3*35,45) =0,0197 mol de fer III.
11,0 g K2C2O4, H2O soit 11,0 / (2*39,1+24+64+18)=0,0597 mol d'ion oxalate et 0,0597*2 = 0,119 mol d'ion potassium.
A
partir de 0,0197 mol d'ion Fe(III) il faudrait 3*0,0197 = 0,0591 mol
d'ion oxalate ; on en a 0,0597 mol : les proportions sont
pratiquement stoechiométriques.
Dans 7,63 g de
K3[Fe (C2O4)3], 2H2O, il y a : 7,63 / (3*39,1 +55,85 +3*88+36) =0,016125 mol de fer III soit 3*0,016125 =0,048378 mol d'oxalate.
rendement : 0,048378 / 0,0597 =0,81 ( 81 %).
|
Le spectre infrarouge du complexe est
fourni en fin de première partie. Lors d'une analyse spectroscopique (IR,
RMN…), un rayonnement est envoyé sur l'échantillon à analyser : on mesure alors
les fréquences absorbées ou émises par l'échantillon, ce qui donne des
informations sur sa structure. Ces fréquences correspondent en effet à des
transitions énergétiques caractéristiques de l'échantillon.
Quel est l'ordre de grandeur des
énergies mises en jeu lors d'une analyse IR ? Quelle est l'influence de ce
rayonnement sur la molécule (autrement dit, quel type de transitions
électroniques sont étudiées en IR) ?
0,1 à 1 eV : spectroscopies vibrationnelle et rotetionnelle.
Interpréter le spectre fourni.
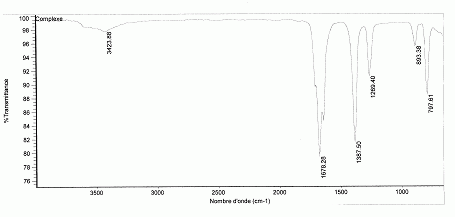
3423 cm-1 : vibration OH associée par liaison hydrogène ;
1678 cm-1 : carbonyle C=O ;
1387 cm-1 : liaison C-O ;
797 cm-1 : liaison C-C.
|

