propriétés et structures de quelques alcalins.
Lorsque l'on évoque les alcalins,
on parle de métaux alcalins.
Donner trois propriétés caractéristiques des
métaux. Donner un exemple d'élément qui n'est pas un métal.
- Ils réagissent violemment avec l'eau. Ce sont des réducteurs.
- Ils se dissolvent dans l'ammoniac liquide.
- Ce sont des métaux moux, de faible densité, à bas point de fusion.
L'élément hydrogène appartient à la colonne des métaux alcalins, mais ce n'est pas un métal.
Donner la configuration
électronique du rubidium dans son état fondamental. Enoncer les règles
permettant d'établir cette configuration électronique.
Règle de Pauli : deux électrons se
différencient par au moins l'un de leur nombres
quantiques n, l, m et s.
Règle de Klechkowski : l'ordre de
remplissage des orbitales se fait suivant (n+l) croissant ;
si deux orbitales atomiques ont le même nombre (l+n),
celle qui a la plus faible valeur de n est remplie en
premier ( principe de stabilité)
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f...
Règle de Hund : cas des orbitales de
mêmes énergie.
Les électrons de spins parallèles occupent
le maximum d'orbitales.
37 Rb : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1.
En déduire en le justifiant la
structure générale de la couche externe des alcalins. Que peut-on attendre
comme degré d'oxydation pour ces éléments ? Donner un exemple de composé
naturel vérifiant cette propriété.
Les éléments de la 1ère colonne de la classification possède
un seul électron externe, facilement perdu au cours des réactions
chimiques. Il en résulte un cation M+. Le degré d'oxydation des métaux alcalins est +1.
Na2O ; Na2 CO3.
Pour mettre en évidence le
caractère réducteur des alcalins, une simple expérience, quoique
dangereuse, peut suffire :
qu'observe-t-on lorsque l'on met du sodium dans de l'eau? Interpréter (on
donnera l'équation bilan de la réaction mise en jeu). Comment
conserve-t-on le sodium pour éviter tout danger ?
On observe un dégagement d'hydrogène : Na(s) + H2O(l) = Na+aq +½H2(g) + HO-aq.
Le sodium est conservé dans l'huile ou dans le pétrole, à l'abri de l'humidité.
Les alcalins peuvent exister sous
la forme d'oxydes, de peroxydes, de
superoxydes et d'ozonides.
Donner la formule de l'oxyde de lithium,
du peroxyde de sodium, du superoxyde de potassium et de l'ozonide de
rubidium en précisant pour chaque composé le nombre d'oxydation de
l'oxygène.
Li2O : n.o( O) = -2 ; Na2O2 : n.o( O) = -1
KO2 : n.o( O) = -½ ; KO3 : n.o( O) = -1/3.
|
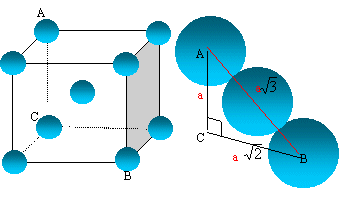
Les métaux alcalins cristallisent
dans une structure cubique centrée.
Dessiner cette structure et calculer
sa compacité.
|
Les 8 atomes situés aux sommets du cube sont
communs à 8 mailles et comptent pour 1/8=0,125 ;
celui du centre, commun à une seule maille, compte
pour une unité.
Nombre d'atomes d'uranium appartenant à la maille
: 8* 0,125 +1 =
2.
La compacité
C, comprise entre 0 et 1, mesure le taux
d'occupation de l'espace par les atomes ou les ions
assimilés à des sphères. C= volume
occupé / volume de la maille.
volume occupé : 2*(4/3pR3)
; volume de la maille : a3 ; et
R/a
= racine carrée (3) /4= 0,433
C= 8/3p
(R/a)3=8/3*3,14*0,4333
=
0,68
, structure peu compacte.
L'oxyde de lithium peut être obtenu
en chauffant du lithium dans l'air à 200°C. Ecrire la réaction de
formation de cet oxyde.
4 Li(s) + O2(g) = 2Li2O (s).
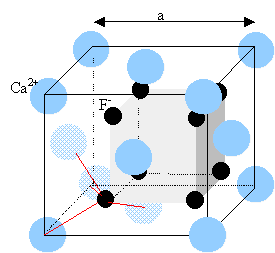
Le composé ainsi obtenu cristallise dans
une structure de type "antifluorine" : les anions forment un réseau cubique faces centrées et
les cations occupent les 8 sites tétraédriques.
Représenter le réseau de l'oxyde de
lithium.
cristaux du type fluorure de calcium,
fluorine :
Exprimer, en fonction du rayon de
l'anion que l'on notera R = r-, la dimension d'un site tétraédrique
et celle d'un site octaédrique. On admettra pour ce calcul que les anions
sont tangents.
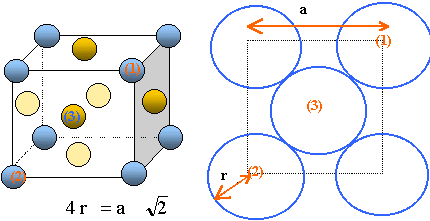
il y a contact des sphères suivant la diagonale
d'une face du cube.
sites octaèdriques :
Ils sont d'une part positionnés au milieu des
arètes de la maille et d'autre part il en existe un
au centre de la maille.
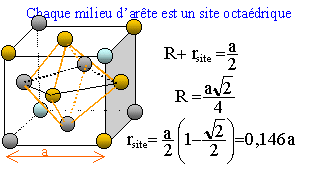
a = 4 R / 2½ =2R 2½ ; rsite = rocta = R 2½ -R = R ( 2½-1).
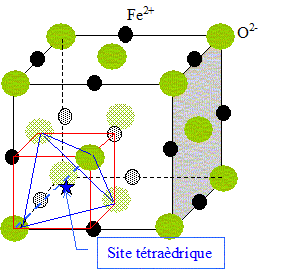
Dimension de la grande diagonale du petit
carré rouge ( figure ci-dessus)
d²= (½a)2 +
(½2½a)2 ; d =
3½ a/2
R +Rtétra
=½d =3½ a/4 ; R
+Rtétra
=(3/2)½R
Rtétra
=(1,5½-1)R
On donne r+ = 70 pm et R =r-
= 140 pm : quels sites devraient occuper les cations? Est-ce le cas ?
Proposez une explication.
Rtétra
=(1,5½-1)R =(1,5½-1)*140 = 31,4 pm.
rocta = R ( 2½-1) =140 ( 2½-1) = 58 pm
Les cations ont un rayon supérieur au rayon des sites : il y a déformation du réseau CFC.
Exprimer la masse volumique de
l'oxyde de lithium en fonction du paramètre de maille a et des masses
molaires du lithium et de l'oxygène. Faire le calcul pour a = 464 pm.
Il y a 8 cations ( occupant 8 sites tétraèdriques) et 4 cations propres à la maille.
Masse d'un cation : MLi / NA ; masse d'un anion : MO / NA ;
masse des ions dans une maille : m = 8 MLi / NA + 4MO / NA ;
volume de la maille : V = a3 ;
masse volumique : r = m/V = ( 8 MLi / NA + 4MO / NA) / a3 ;
A.N : (8*6,94 10-3 + 4 *16 10-3) /( 6,02 1023 *(464 10-12)3) =1,99 103 ~ 2,0 103 kg m-3.




