Les ions nitrite NO2-(aq)ont
incolores en solution aqueuse. Pour les doser dans une solution
aqueuse, on peut, après prélèvement d'un échantillon de 1,0 mL de
solution, ajouter 1 mL de réactif de Griess. La
solution se colore alors en rose, ce qui permet d'effectuer un dosage
colorimétrique. La mesure de l'absorbance de la solution obtenue se
fait grâce à un spectrophotomètre qui a été réglé sur la longueur
d'onde l= 520 nm.
On réalise cette opération pour doser les ions nitrite dans un aquarium
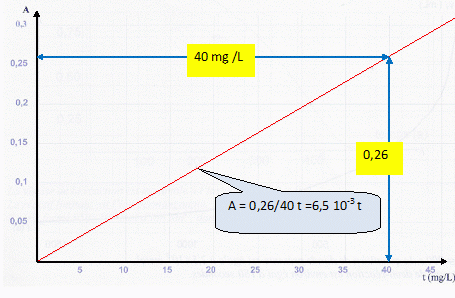
et on mesure une absorbance A = 0,15. Des solutions étalons, préparées
dans les mêmes conditions ont permis d'obtenir le graphe
A = f(t) représenté ci-dessous, où t est la concentration massique en
ions nitrite dans l'échantillon prélevé.
A. La longueur d'onde
choisie correspond à un minimum d'absorption de la solution. Faux.
La longueur d'onde choisie correspond à un
maximum d'absorption
de la solution.
B. La solution obtenue avec le
réactif de Griess n'absorbe pas le rouge. Vrai.
La solution rose absorbe la
couleur complémentaire du rose, la partie bleu vert du spectre de la
lumière blanche.
C. La concentration
massique en ions nitrite est environ égale à 23 mg/ L. Vrai.
0,15 = 6,5 10-3
t ; t = 150/6,5 =23 mg/L.
D. La concentration
molaire en ions nitrite dans l'aquarium est égale à 0,50 mol/L. Faux.
Masse molaire de l'ion nitrite : M = 14
+32 = 46 g/mol ; 23 10-3 / 46 = 5 10-4
mol/L.
Le
diiode I2(aq) réagit avec le métal zinc Zn(s). La
transformation qui se produit est modélisée par l'équation chimique :
I2(aq) + Zn(s) = Zn2+ (aq)+ 2 I-(aq)
On plonge une lame de zinc dans un volume V0 = 20,0 mL de
solution de diiode à la concentration molaire en soluté apporté C0
= 2,00x 10-2 mol.L -1. A intervalles de temps
réguliers, on prélève
V = 1,00 mL de milieu réactionnel, que l'on dose par une solution de
thiosulfate de sodium (2 Na+(aq) +S2032-(aq)
à la concentration C1 = 1,00x 10-3 mol.L-1.
La réaction de dosage a pour équation chimique :
2S2032-(aq) + I2(aq) = S4062-(aq)
+ 2 I-(aq)
Le volume nécessaire à l'obtention de l'équivalence est noté V1.
A. La quantité initiale
de diiode est n0= 0,400 mmol. Vrai.
V0C0
=0,020 *2,00x 10-2 = 4,00 10-4
mol = 4,00 10-1 mmol.
B. La quantité n de
diiode présente dans chaque prélèvement est donnée par la relation : n
=½C1V1. Vrai.
n(S2032-(aq)) = C1V1
; n = ½n(S2032-(aq)) =½C1V1.
Les résultats des différents dosages permettent de tracer la courbe de
la figure suivante.
C. A t = 900 s, la
quantité n de diiode présente est égale à 2,5 x l0-3 mmol. Vrai.
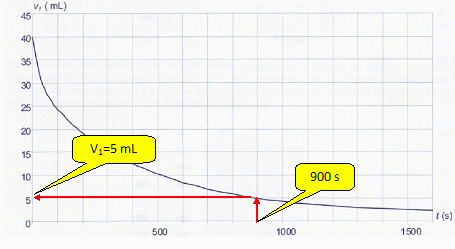
n =½C1V1
= 0,5*1,00x 10-3 * 0,005 = 2,5 10-6
mol = 2,5 10-3 mmol.
D. Le temps de
demi-réaction est environ égal à 180 secondes. Vrai.
Le zinc est en excès.
L'avancement final est égal à 0,400 mmol.
Au temps de demi-réaction,
l'avancement vaut 0,200 mmol de
diiode dans 20 mL de solution
soit 0,2/20 =0,01 mmol dans le prélèvement de 1 mL.
V1
vaut : 2 n / C1 = 2,0 10-5/
1,00x 10-3 = 0,020 L = 20 mL. Le graphe donne alors t½
= 180 s.
|
On mélange un volume
V1 = 1,00 mL d'une solution aqueuse de permanganate de
potassium
(K+(aq) + Mn04-(aq)de concentration
molaire en soluté apporté C1= 9,50 x 10-4 mol/ L,
acidifiée par de
l'acide sulfurique, à un volume V2 d'une solu!ion aqueuse
d'acide oxalique H2C204(aq) de
concentration
molaire en soluté apporté C2.
La réaction mise en jeu est lente et considérée comme totale. La
transformation qui se produit est
modélisée par l'équation chimique :
2 Mn04-(aq) + 5 H2C204(aq)+ 6 H+(aq)
= 2 Mn2+(aq) + 10 CO2(aq)+ 8 H2O(1)
Toutes les espèces chimiques intervenant dans cette réaction sont
incolores, sauf l'ion permanganate.
A. Dans la réaction
étudiée l'acide oxalique a été réduit. Faux.
L'ion permanganate est l'oxydant, il se
réduit. L'acide oxalique est le réducteur, il s'oxyde.
A une longueur d'onde appropriée, on suit son évolution à l'aide d'un
spectrophotomètre relié à un
ordinateur, en mesurant l'absorbance A du mélange réactionnel en
fonction du temps (courbe suivante).
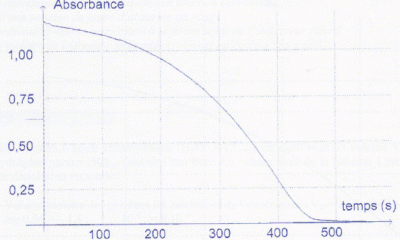
B. La vitesse de la
réaction est maximale à l'instant initial (t = 0 s).
Faux.
La réaction est autocatalysée par les ions
Mn2+(aq), inexistant à t=0.
La tangente à la courbe est pratiquement horizontale à t = 0 ; son
coefficient directeur est proche de zéro. La vitesse est
proportionnelle à ce coefficient directeur.
C. Le réactif limitant est l'ion
permanganate. Vrai.
L'ion permanganate est la
seule espèce à absorber à la longueur d'onde choisie. L'absorbance
finale étant nulle, l'ion permanganate est en défaut.
D. Il s'est formé 950 x10-9
mol d'ion Mn2+ dans l 'état final. Vrai.
V1 C1=
10-3 * 9,50 x 10-4 = 9,50 x 10-7
=
950 x 10-9
mol.
|
A
l'instant choisi t = 0 s, on introduit de l'éthanoate de méthyle de
formule C3H602(1) dans un bécher
contenantde l'hydroxyde de sodium (Na + (aq)+ HO-
(aq)), on obtient un volume V= 100 mL de solution.
Les concentrations molaires initiales de toutes les espèces chimiques
sont égales à C0= 0,10 mol/L.
La transformation qui se produit est modélisée par l'équation chimique:
C3H602(1) + Na + (aq)+ HO-
(aq)=Na + (aq) + A- (aq) + B(aq).
La température est maintenue à 30°C.
On plonge dans le mélange la sonde d'un conductimètre qui permet de
mesurer à chaque instant la conductivité s(t)de la solution. Celle-ci est
reliée à l'avancement par la relation suivante:
x(t) =C0V( s0-s) / (s0-soo)
où too correspond à un instant de date très grande où la
transformation chimique est supposée terminée.
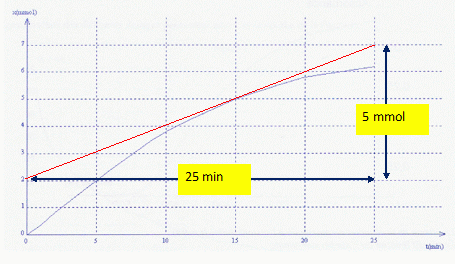
L'évolution de l'avancement au cours du temps est donnée par la courbe
ci dessous :
A. Le produit A-(aq)est
l'ion éthanoate. Vrai.
B. La conductivité de la
solution augmente au cours du temps.
Faux.
Du
point de vue de la conductivité, tout se passe comme si on remplaçait
l'ion hydroxyde par l'ion éthanoate de conductivité ionique bien
moindre ; la conductivité va diminuer.
C.
Le temps de demi-réaction est égal à 15 minutes. Vrai.
La réaction est totale ;
l'avancement final vaut VC0 = 0,1*0,1 = 0,01 mol = 10 mmol. Au temps
de demi-réaction l'avancement vaut : 5 mmol. Le graphe indique t½
= 15 min.
D. A la date t = 15 min
la vitesse volumique de la réaction a pour ordre de grandeur v = 0,20
mmol.L-1.min-l.
Faux.
v = 1/V [dx/dt ]15
=1/0,1 *5/25 = 2 mmol.L-1.min-l.
Le jaune d'alizarine est un indicateur coloré dont le pKa est
égal à 11. Sa forme acide a une teinte jaune, sa forme basique une
teinte rouge.
On a représenté ci-dessous la formule topologique d'une des formes
présentes dans une solution de cet indicateur coloré.
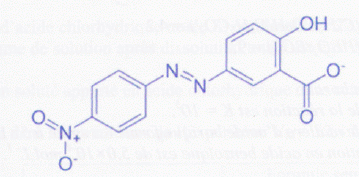
A. La forme représentée
ci-dessus possède une fonction carboxylate. Vrai.
B. A pH = 8, une solution
de jaune d'alizarine est rouge.
Faux.
A
pH inférieur à pKa la forme acide jaune prédomine.
C.
L'ion représenté ci-dessus correspond à la forme acide de l'indicateur
coloré. Faux.
La
forme acide possède une fonction acide carboxylique -COOH et non pas un
ion carboxylate.
D.
La masse molaire de la forme représentée ci-dessus est égale à 286
g/mol. Vrai.
C13H8N3O5
: M = 12*13+8+3*14+5*16 =286 g/mol.
On réalise une solution d'acide chlorhydrique (H30+
+Cl-(aq)) en dissolvant un volume V0= 1,0 L de
chlorure d'hydrogène gazeux HC1(g)dans de l'eau pure. Le volume final
de la solution 1 est VI = 1,0 L.
La réaction de dissolution est totale.
Données: Volume molaire des gaz dans les conditions de l'expérience: Vrn=
25 L/mol.
log 0,04 = - 1,4 ; 10-2,1= 8.10-3.
A. La concentration
molaire en ions H30+est égale à 1,0 mol/L. Faux.
n(HCl gaz) = V / Vm
=1/25 = 0,040 mol dans
1 L.
B.
Le pH de la solution 1 est pHI = 1,4.Vrai.
pH = -log [H30+]
= -log 0,04 = 1,4.
A partir de la solution l, on veut préparer une solution 2 de pH égal à
pH2 = 2,1.
C. On doit diluer la
solution 1 au cinquième. Vrai.
Facteur de dilution =
concentration mère / concentration fille = 0,04 / 10-2,1
= 0,04 / 8.10-3= 5.
D. La dilution s'effectue
dans une fiole jaugée. Vrai.
A 25°C, on étudie la
réaction de l'acide benzoïque C6H5C02H(aq
) sur l'ion borate B02-(aq).
On mélange 10 mL d'une solution d'acide benzoïque de concentration
molaire en soluté apporté C =1,0 x 10-3 mo1/L et V=5 mL
d'une solution de borate de sodium (Na+(aq) + B02-(aq)
de
concentration molaire
en soluté apporté C =1,0 x 10-3
mo1/L
Données :
A 25°C, pKal (C6H5C02H(aq
)/C6H5C02-(aq
)) =4,2
; pKa2 (HB02 /B02-(aq)) = 9,2.
A. Le réactif limitant
est l'ion borate. Vrai.
C6H5C02H
+B02-(aq) = C6H5C02-(aq
) +HB02 aq.
Les réactifs ont même
concentration initiale et le volume de solution de borate de sodium est
égal à la moitié de celui d'acide benzoïque.
B.
La constante d'équilibre de la réaction est K = 105. Vrai.
L'acide
benzoïque est l'acide le plus fort, l'ion borate la base la plus forte
et la différence des pKa est égale à 5.
C. A l' équilibre, la quantité de
matière d'acide borique formé est égale à 5 x10-3 mol. Faux.
La réaction est totale ( la constante
d'équilibre étant grande ). A l'équilibre, la quantité de matière
d'acide borique formé est n=CV =1,0 x 10-3
*0,005 = 5 10-6 mol.
D. A
l'équilibre, la concentration en acide benzoïque est de 5,0 x10-4
mol/L. Faux.
Il
reste 5 10-6 mol d'acide benzoïque dans15 mL ou 0,015 L : [C6H5C02H(aq
)]fin =5 10-6 /0,015 = 3,3 x10-4
mol/L.
A 25°C, on désire déterminer la concentration d'une solution aqueuse
d'éthylamine, de formule brute C2H7N, présente
dans un flacon de 500 mL. On procède alors à un dosage pH-métrique par
une solution
d'acide chlorhydrique de concentration molaire en soluté apporté 0,100
mo1/L. On prélève 20,0 mL de la solution d'éthylamine et on suit
l'évolution du pH.
Le graphe pH =f(Va) où Va est le volume d'acide chlorhydrique versé est
représenté ci-dessous.
L'éthylamine appartient à un couple acido-basique dont le Ka a pour
valeur 10-10,7 à 25°C.
Donnée : Ke = 10-14 à 25°C.
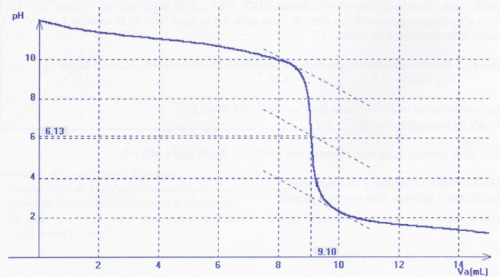
A. L'acide conjugué de l'éthylamine a
pour formule C2H8N+. Vrai.
C2H7N
+ H+ aq = C2H8N+.
B. A pH = 9, l'acide conjugué
prédomine sur la base éthylamine. Vrai.
A
pH inférieur au pka ( 10,7), la forme acide prédomine.
C. La constante d'équilibre de la
réaction entre l'acide chlorhydrique et l'éthylamine est K = 10+3.3. Faux.
Réaction entre l'acide le plus fort et la
base la plus forte : la constante d'équilibre est égale à 10 exposant
"la différence des pKa ":
pKa ( H3O+aq/H2O(l)
= 0 ; pKa ( / ) = 10,7 ; K = 1010,7.
D. La concentration de la
solution d'éthylamine est Cb= 45,5 mmol/L. Vrai.
A
l'équivalence : n(H3O+aq)
= 9,10 10-3 * 0,100 = 9,10 10-4
mol.
n(C2H7N ) =0,020 Cb
= 9,10
10-4 mol ; Cb =9,10 10-4
/0,020 =0,0455 mol/L = 45,5 mmol/L.
|
On a préparé une solution notée S1
en dissolvant une masse ml = 0,945 g d'acide
monochloroéthanoïque ClCH2-COOH ( M = 94,5 g/mol ) dans l'eau. Le volume de solution, après
dissolution totale, est égal à VI = 1,00 L. LepH de cette
solution
vaut pHI =
2,5.
La concentration molaire
en soluté apporté en acide monochloroéthanoïque dans cette solution SI
est
notée CI.
On a préparé une
solution d'acide chlorhydrique notée S2 en dissolvant 22,4
mL de chlorure d'hydrogène
gazeux dans l'eau. Le
volume de solution après dissolution totale est égal à V2 =
100 mL. LepH de cette
solution vaut pH2
=2,0.
La concentration molaire
en soluté apporté en acide chlorhydrique dans cette solution S2
est notée C2.
Données: volume molaire
dans les conditions de l'expérience VM=22,4 L/mol.
A.
D'après Bronsted, un acide est une espèce chimique capable de céder un
ou plusieurs électron(s). Faux.
Un
acide est une espèce chimique capable de céder un ou plusieurs protons.
B. Les deux concentrations molaires
en soluté apporté sont égales. Vrai.
n(ClCH2-COOH) =m1/M
= 0,945 / 94,5 = 0,01 mol ; C = n/V = 0,01 /1 =0,01 mol/L.
l'acide chlorhydrique est
fort : C = 10-pH2 = 0,01 mol/L.
La transformation chimique, entre chacun des deux acides et l'eau, peut
être modélisée par l'équation
générale : AH(aq)+ H2O(I) = H30+aq + A-(aq)
On appelle t1 et t2 le taux d'avancement final de chacune
des deux réactions associées aux transformations donnant les solutions S1
et S2.
C. Les deux taux
d'avancement sont égaux. Faux.
t1
=10-pH1/C = 10-2,5 / 0,01 =10-0,5
=0,31 ;
t2 =10-pH2/C
= 10-2 / 0,01 =1.
D. Dans l'eau, l'acide
monochloroéthanoïque est moins dissocié en ions que l'acide
chlorhydrique. Vrai.
|
|





