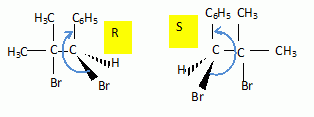
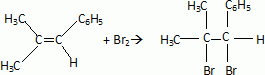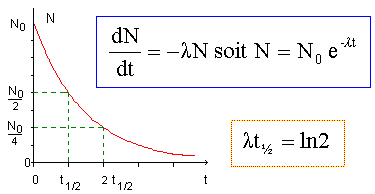L'addition
du dibrome sur le 2-méthyl- 1-phénylpropène (A) conduit à un dérivé B
de formule C10H12Br2.
Ecrire la réaction
chimique en donnant les formules semi-développées de A et B.
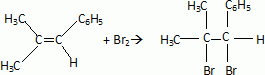
Existe
t-il plusieurs isomères de A et B ? Si oui, les représenter.
(A) ne présente pas l'isomèrie Z- E , l'un des carbones doublement lié
porte les mêmes groupes CH3.
(B) possède un atome de carbone asymétrique : il existe deux
énantiomères.
Sous
quelle forme se présente le dibrome ? Quelle précaution devez vous
prendre pour le manipuler, en particulier pour réagir en cas de
renversement ?
Le dibrome est un liquide rouge ; travailler sous hotte.
Prévoir
un cristallisoir de thiosulfate de sodium ou de soude, afin de
neutraliser le dibrome par une
réaction d’oxydo-réduction.
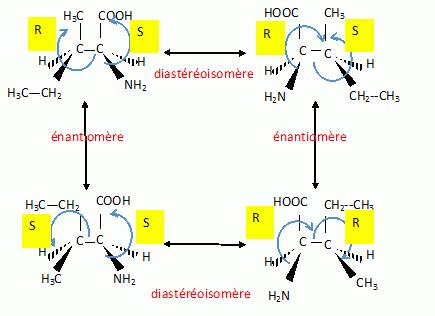
L'acide 2-amino-3-méthylpentanoïque existe sous deux formes de composés
chimiques séparable.
Ecrire la
formule semi-développée de l'acide.
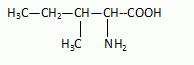
Combien
de stéréoisomères correspondent à cette formule ?
La présence de deux carbones asymétriques conduit à 4 isomères.
le carbone à
l'état naturel contient deux isotopes stables, 12C
majoritaire et 13C
dans des proportions de 98,9 % et 1,1 % en masse. Les masses atomiques
des isotopes sont respectivement de 12,0000 g/mol et 13,0034 g/mol.
Qu'appelle
t-on isotopes ?
Deux isotopes ne se différentient que par leur nombre de neutrons ; ils
ont le même numéro atomique.
Détailler
la structure atomique du 12C.
6 protons et 12-6 = 6 neutrons.
Quelle est la masse
atomique du carbone naturel ?
M = 12,0000*0,989 + 13,0034*0,011 =11,868 +0,14304 =12,0110 g/mol.
Il existe un autre isotope minoritaire du carbone : lequel ? Pourquoi
est-il instable ?
Le
carbone 14 14C :
La demi-vie de cet isotope est t½ =5370 ans. La loi de décroissance
isotopique est de la forme dC/dt = -l
C dans laquelle l est la
constante radioactive, t le temps et C le rapport molaire de l'isotope
exprimé en mole par mole de carbone 12.
Etablir la loi de vitesse donnant la variation de C en fonction du
temps avec un rapport molaire initial de C0.
dC/dt + l C =0
Solution générale de cette équation différentielle du premier ordre
: C(t) = A exp(-l t
) avec A une constante.
C (t=0) = C0 =A exp(0) d'où C0 =A.
C(t) = C0 exp(-l t ).
Donner
l'allure de la courbe correspondante et calculer la valeur de la
constante l.
l = ln 2 / t½
= ln2 / 5370 = 1,29 10-4 an-1.
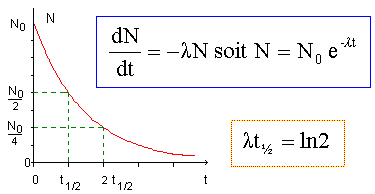
La pyrite est un sulfure naturel de fer FeS2. La combustion à chaud de la pyrite avec l'air en excès fournit de l'oxyde ferrique et du dioxyde de soufre.
Ecrire l'équation chimique de combustion de la pyrite.
2FeS2 + 6,5 O2 = Fe2O3 +4SO2.
Quelle est la thermicité de cette réaction ?
Les combustions sont exothermiques.
En supposant la combustion totale, quelle masse de pyrite faut-il traiter pour obtenir 4,4 kg d'oxyde de fer ?
Masse molaire de l'oxyde de fer : M = 2*56+3*16 = 160 g/mol.
Quantité de matière correspondante : n = m / M = 4400 / 160 = 27,5 moles.
Quantité de matière de pyrite : 2 n = 27,5*2 = 55 moles.
Masse molaire de la pyrite : M = 56+2*32 = 120 g/mol.
Masse de pyrite : 2n M(pyrite) = 55*120 = 6600 g = 6,6 kg.
Combien de moles de dioxyde de soufre sont formées ?
4 n = 4*27,5 =110 moles.
Quelle
est la composition du mélange gazeux issu de la combustion, sachant
qu'on a utilisé le double de la quantité d'air nécessaire : gaz
présents et % en volume ?
Quantité de matière de dioxygène nécessaire : 6,5 n = 6,5 *27,5 = 178,75 moles.
Quantité de matière de dioxygène restant : 178,75 moles.
L'air contient 21 % de dioxygène et 79 % de diazote.
Quantité de matière de diazote : 2*178,75 *79/21 = 1345 moles.
Quantité totale de moles : N = 1345 +178,75 +110 = 1633,6 ~1634 moles.
% SO2 : 110 /16,34 = 6,73 % ; % dioxygène : 178,75 / 16,34 = 10,94 ; % diazote : 1345 / 16,34 = 82,31.
Quel est le volume du gaz de combustion obtenu exprimé dans les conditions normales de température et de pression ?
N Vm = 1633,6*22,4 = 3,66 104 m3.
|
On
réalise l'analyse d'un ester (C) par saponification à chaud de 15 g
d'ester en mélange avec 200 mL de potasse aqueuse à 30 % en poids
pendant 2 heures. Après refroidissement, le traitement du milieu
réactionnel est alors le suivant :
1. Extraction du milieu réactionnel par le chloroforme ( 3 *100 mL),
traitement des phases organiques récupérées par le sulfate de
magnésium, filtration et passage à l'évaporateur rotatif. On récupère
10,8 g d'un produit liquide (D).
2. Traitement de la phase aqueuse résiduelle par de l'acide
chlorhydrique jusu'à pH= 1, extraction par le chloroforme ( 3*100 mL),
traitement des phases organiques récupérées par le sulfate de
magnésium, filtration et passage à l'évaporateur rotatif. On récupère 6 g d'un produit liquide (E).
Ecrire la réaction générale précédente, expliquer l'ensemble des opérations réalisées.
C + K+ + HO- = D + E- + K+.
E- est l'ion carboxylate issu de l'acide carboxylique E.
D est un alcool, beaucoup plus soluble dans le chloroforme que dans l'eau.
E-, ion carboxylate, traité par l'acide chlorhydrique, donne l'acide carboxylique conjugué, peu soluble dans l'eau.
L'extraction par le chloroforme sépare la phase organique de la phase aqueuse.
Le sulfate de magnésium anhydre élimine les traces d'eau.
Lévaporateur rotatif évapore le solvant ( chloroforme ).
La réaction de saponification étant totale, déduire des informations précédentes le nombre de moles de C traitées.
Une mole de C donne une mole de D et une mole de E.
Quantité de matière d'ester n = 15 / M(ester) ;
Quantité de matière de D : n = 10,6 / MD ; quantité de matière de E : n = 6/ ME.
Par suite : 15 / M(ester) = 10,8 / MD = 6/ ME.
Donner la formule brute de C à partir de son analyse élémentaire ( C : 72,0 % ; H : 6,67 %).
% O = 100-72 -6,67 =21,33
Formule brute de C : CxHyO2 : 32/0,2133 = M(ester) = 150 g/mol.
12 x / 0,72 = M = 150 ; x = 150*0,72/12 =9 ;
y / 0,0663 = M(ester) = 150 ; y = 150 *0,0663 ~ 10. Donc C9H10O2.
En déduire la masse molaire, la formule brute et le nom de E.
Quantité de matière d'ester n = 15 / 150 = 0,1 mol.
6/ ME = 0,1 ; ME =60 g/mol.
CH3-COOH, acide éthanoïque.
En déduire la masse molaire, la formule brute, une formule développée et le nom de D.
10,8 / MD =0,1 ; MD =108 g/mol. C7 H8 O.
C6H5-CH2OH, alcool benzylique.
En déduire la formule développée et le nom de C.
CH3-COO -CH2 -C6H5. Ethanoate de benzyle.
|
L'acide acétique possède un pKa de 4,75 à 25°C.
Comment peut-on considérer la force de cet acide et pourquoi ?
A concentration égale, plus le pKa se rapproche de zéro, plus l'acide est fort. Un acide fort a un pKa égal à zéro. L'acide acétique est un acide faible.
Donner
les équations permettant de calculer le pH d'une solution diluée
d'acide acétique dans l'eau avec une concentration initiale c0.
CH3COOH + H2O = H3O+ + CH3-COO-. Ka =1,78 10-5 = [CH3-COO-][H3O+] / [CH3COOH].
Conservation de l'élément carbone : [CH3COOH] + [CH3-COO-] = c0.
La solution est électriquement neutre : [CH3-COO-] + [HO-] = [H3O+].
Rappeler en les justifiant les simplifications d'usage permettant d'exprimer le pH en fonction de pKa et de c0.
En milieu acide [HO-] peut être négligé, d'où : [CH3-COO-] ~ [H3O+].
L' acide est peu dissocié : [CH3COOH] ~ c0.
Ka =1,78 10-5 ~[H3O+]2 / c0 ; log Ka = 2 log [H3O+] - log c0 ; -log Ka = -2 log [H3O+] + log c0 ;
pKa = 2 pH +log c0 ; pH = ½(pKa - log c0 ).
A.N : c0 = 0,1 mol/L ; pH = 0,5 (4,75 -log0,1) = 2,9.
c0 = 10-6 mol/L ; pH = 0,5 (4,75 +6) = 5,4.
Calcul sans l'approximation [CH3COOH] ~ c0 : 1,78 10-5 =x2 / (c0-x) ; avec x = [H3O+] avancement volumique final.
1,78 10-5 (10-6 -x) = x2 ; 1,78 10-11 - 1,78 10-5 x = x2 ; x2 +1,78 10-5 x- 1,78 10-11 =0.
D = (1,78 10-5 )2+4*1,78 10-11 =3,88 10-10 ; D½ =1,97 10-5 ;
x = 0,5 ( 1,97-1,78) 10-5 = 9,49 10-7 ; pH = -log(9,49 10-7) = 6,0.
L'écart est de 10 % ; la seconde approximation ne doit pas être faite.
|