Indiquer les
formules chimiques des composés ci-dessous :
permanganate de potassium, sulfate de magnésium heptahydraté, pentoxyde
de vanadium(V).
KMnO4, MgSO4,7H2O, V2O5.
Donner
les formules semi-développées des composés ci-dessous :
hexanoate de butyle, acide paratoluène sulfonique, N,N-diméthylaniline.
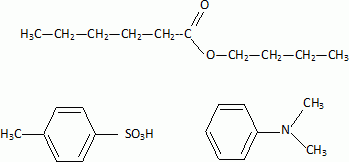
Donner le
nom des composés ci-dessous :
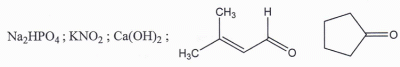
hydrogénophosphate de sodium ; nitrite de potassium ; hydroxyde de
calcium ; 3-méthylbut-2-ènal ; cyclopentanone.
|
Le phénomène
d'eutrophisation des eaux est dû aux adjuvants des détergents ;
- polyphosphates ( vrai
)
- savons
- silicates
- perborates
A
quoi correspond le phénomène d'eutrophisation et quelles en sont les
conséquences ?
Ce phénomène est la
modification et la
dégradation d'un milieu aquatique,conséquence d'un apport excessif de
substances nutritives ( azote, phosphore ) ; la production d’algues et
de plantes aquatiques est accrue.
Conséquences
: diminution de la biodiversité et de la qualité de l'eau,
augmentation du volume d'algues, odeur désagréable, envasement plus
rapide.
|
Un savon
comporte une chaîne carbonée et une fonction carboxylate de sodium.
- la chaîne carbonée est hydrophile, lipophile,
amphiphile ?
- Quel est le
rôle de la fonction carboxylate de sodium ?
Le groupe carboxylate est la partie hydrophile.
- Que
deviennent les savons rejetés dans les eaux usées ?
Le savon fabriqué avec des corps gras
naturels a un impact réduit sur l'environnement.
Le savon de Marseille ( préparé avec de l'huile d'olive et de la soude
) est totalement biodégradable.
Les savons industriels contiennent des additifs plus ou moins
polluants, difficiles à dégrader.
Certains
gaz forment des mélanges explosifs avec l'air. Donner les formules
chimiques de chaque gaz et indiquer le risque d'explosivité.
- ammoniac : NH3, pas de risque sérieux
d'incendie ou d'explosion, les mélanges ammoniac - air étant
difficiles à enflammer
- argon :
Ar, l’argon n’est pas dangereux à faible concentration ( l'air
contient 0,9 % d'argon )
-
dihydrogène H2, le mélange dihydrogène air est explosif
pratiquement en toute proportions
- dioxygène : O2, pas de risque d'explosion, mais risque
accru d'inflammation des combustibles mis en contact aved le dioxygène
- hélium : He, pas de risque d'explosion
- chlorure d'hydrogène : HCl, Le chlorure d’hydrogène est un composé
ininflammable et inexplosible.
Mais en
présence d’eau, son action
corrosive sur de nombreux métaux s’accompagne d’un dégagement
d’hydrogène : le chlorure d’hydrogène est une source secondaire
d’incendies et d’explosions.
Certains composés chimiques peuvent être
présents à température ambiante sous forme de vapeurs dangereuses à
inhaler.
Donner la
formule brute de chacun et le risque de toxicité.
- Benzène : C6H6, une exposition de cinq à dix
minutes à un taux de benzène dans l'air de 2 % environ suffit pour
entraîner la mort.
- brome : Br2, très toxique par inhalation
- diazote : N2, aucun risque ( près de 80% de l'air )
- dichlorométhane : CH2Cl2, le contact prolongé
avec la peau peut provoquer des irritations ou des brûlures.
- hélium : He, une inhalation d'une grande quantité en une seule fois,
produit une légère asphyxie.
- nitrate d'ammonium NH4NO3, après inhalation de
poussières, toux et maux de tête, eu toxique mais c'est un comburant
donnant des réactions violentes avec des composés organiques
réductibles.
Parmi les couples de composés chimiques ci-dessous, certains
ne doivent pas être stockés dans une même armoire.
Indiquer
lesquels et expliquer le risque.
- sulfate de magnésium et soude caustique
- acide sulfurique à 98% et potasse : réaction acide base très
exothermique.
- acide chlorhydrique à 35 % et cyanure de potassium : la
réaction donne un gaz, HCN, très toxique.
- eau oxygéné à 110 volumes et hydrazine : réaction d'oxydoréduction
violente entre un comburant et un carburant.
- eau de javel et chlorure de potassium
- toluène et nitroméhtane
Quels sont les
différents types d'extincteurs susceptibles d'^etre présents dans un
laboratoire de chimie ?
Les feux sont
classés en 4 classes: A : feux de solides ; B : feux de liquides ; C :
feux de gaz ; D : feux de métaux. On y ajoute les feux d'origine
électrique E.
agent
extincteur
|
type
de feux
|
A
|
B
|
C
|
D
|
E
|
eau
pulvérisée
|
x
|
|
|
|
|
eau
pulvérisée avec additif AFFF
|
x
|
x
|
|
|
|
poudres
BC
|
x
|
x
|
x
|
|
|
oudres
ABC
|
x
|
x
|
x
|
|
|
poudre
spéciale
|
|
|
|
x
|
|
dioxyde
de carbone
|
|
|
x
|
|
x
|
Que
faire devant un collègue ayant des vétements en feu ?
devant un collègue ayant les vétements en feu : le couvrir
d'une couverture pour étouffer le feu.
Vous
constatez qu'un étudiant dans votre laboratoire est allongé sur le sol
en contact probable avec un conducteur électrique, comment devez-vous
réagir ?
Couper le courant, appeler les secours.
Vous manipulez de l'azote liquide pour le transvaser d'un conteneur
isotherme à un autre.
- Quelle est
la température approximative de ce liquide ? -196 °C.
Pourquoi
observe t-on des vapeurs blanches lors du transvasement ?
La vapeur d'eau se transforme en glace.
Quels
sont les risques encourus lors de cette manipulation et quelle
précautions faut-il prendre ?
Risque de brûlures par le froid : port de gros gants isolants, de
pantalon, blouse, souliers fermés ;
- risque d'anoxie par manque d'oxygène ( ventilation de l'espace où
l'azote liquide est utilisé ).
La
composition volumique moyenne de l'air sec peut être considérée comme
suit : diazote : 78,03 %, dioxygène : 20,99 %, argon : 0,94 %,
dioxyde de carbone : 0,03 % et 0,01 % d'autres gaz rares.
Citer les
gaz rares potentiels.
l'hélium, le néon, le krypton, le xénon et le radon.
En
considérant l'air et ses composants comme des gaz parfaits, calculer la
masse molaire de l'air ( Vm = 22,4 L mol-1
; négliger le 0,01% d'autres gaz rares ).
M = 0,7803 *28 + 0,2099 *32 + 3 10-4 *44 + 9,4 10-3
*40 =21,8484 +6,7168 +0,0132 +0,376 =28,95 ~29 g/mol.
En
supposant que l'on sache séparer parfaitement chaque composant de
l'air, quel volume d'air doit-on traiter pour obtenir 1 m3 d'argon ?
1 / 9,4 10-3 = 106 m3 d'air.
On comprime l'argon ainsi isolé dans un conteneur en acier de 50 L. Quelle est la
pression à l'intérieur du conteneur et la masse de gaz correspondante
?
Quantité de matière d'argon : n = V/Vm = 1000/22,4 = 44,64
mol
Masse d'argon : m = n M = 44,64 *40 = 1786 g ~ 1,8 kg.
Loi des gaz parfaits : P = nRT/ V = 44,64 *8,32*273 / 0,05 =2,0 106
Pa ~20 bar.
|
Exprimer les unités
suivantes en puissance de 10 par rapport aux unités du système
international ( mètre, kilogramme, seconde).
- hectolitre : 100 L ou 0,1 m3.
- millilitre : 10-3 L = 10-6 m3.
- nanomètre : 10-9 m.
- microgramme : 10-6 g = 10-9 kg.
- picoseconde : 10-12 s. - heure = 3600 s.
Un chauffe ballon alimenté sous une tension de 225 V est parcouru
par un courant de 0,75 A.
Combien
vaut la résistance électrique de cet appareil ?
R = U / I = 235 /0,75 = 3,13 102 ~ 3,1 102 ohms.
Quelle
est la puissance électrique consommée ?
P = U I = 235*0,75 = 176 W ~1,8 102 W.
Dans l'eau, à 25°C, le produit de solubilité de l'hydroxyde de
magnésium Ks vaut 6 10-12.
Ecrire
la relation liant Ks aux concentrations
des ions en solution. En quelle unité s'exprime Ks ?
Ks = [Mg2+aq][HO-aq]2,
constante sans unité, qui ne dépend que de la température.
Quelle
masse d'hydroxyde de magnésium peut être dissoute dans un litre d'eau
pure ?
Mg(OH)2 (s) = Mg2+aq
+ 2HO-aq.
On pose s = [Mg2+aq]
; la solution est électriquement enutre : 2 [Mg2+aq] = [HO-aq] = 2 s.
Ks =
[Mg2+aq][HO-aq]2 = s (2s)2
= 4 s3 ; s = [ Ks/ 4]1/3 = [ 6 10-12/ 4]1/3 =1,145 10-4
mol/L
masse : s M = 1,145 10-4
( 24,3 +2*17) = 6,676 10-3 ~6,7 10-3 g.
Quelle
masse d'hydroxyde de magnésium peut être dissoute dans une solution
aqueuse centimolaire de chlorure de magnésium ?
[Mg2+aq]
= s' + 0,01 ~0,01 mol/L.
Ks = [Mg2+aq][HO-aq]2
= 0,01 (2s')2 =0,04 s'2 ;
s' = [ Ks/ 0,04]½= [ 6 10-12/ 0,04]½ =1,225 10-5
mol/L ( l'approximation faite est justifiée )
masse : s' M = 1,225 10-5 ( 24,3 +2*17) ~ 7,1
10-4 g.
|
|

