Préparation
d'une solution de permanganate de potassium pour doser une
solution de fer (II).
La préparation d'un volume de solution titrée à partir d'une substance
commerciale s'effectue en quatre phases :
- préparation d'une solution trop riche, c'est à dire de concentration
molaire légèrement supérieure à la concentration demandée
- étalonnage de cette solution trop riche
- ajustage de la concentration désirée par dillution
- dosage de contrôle.
Pour réagir le permanganate a besoin d'être en milieu acide sulfurique.
On préparera d'abord un volume V' = 500,0 mL de solution environ 2
mol/L en acide sulfurique.
Sur la solution commerciale, on peut lire : H2SO4,
M~98,10 g/mol, pureté ou titre massique 96 %, densité d = 1,83.
Quelles sont les
précautions à prendre lors de l'utilisation de solution d'acide
sulfurique concentrée ?
Port de blouse, gants et
lunettes de sécurité et travail sous hotte aspirante.
Calculer la
concentration en acide sulfurique de la solution commerciale.
Masse de 1 L : 1,83 kg = 1,83 103 g. Dans 1 L, masse d'acide
pur : 0,96 * 1,83 103 =1,7568 103 g.
Concentration en acide sulfurique : 1,7568 103 / 98,1 = 17,9
~18 mol/L.
Quel est
le volume d'acide sulfurique commerciale que l'on doit prélever pour
préparer 200 mL ?
Facteur de dilution F = concentration commerciale / concentration de la
solution fille diluée
F = 18/2 = 9.
Volume de solution commerciale à prélever = volume de la solution fille
diluée / F = 200 / 9 ~22 mL.
|
Quelle est la masse
de permanganate de potassium solide que l'on doit peser pour préparer
200 mL d'une solution de concentration molaire exactement 0,050 mol/L ?
M(KMnO4) = 39,1 + 54,9 +4*16 =158 g/mol
Quantité de matière KMnO4 =
volume ( L) fois concentration (mol/L)
n = 0,200*0,050 =0,010 mol
masse (g) = masse molaire ( g/mol) * quantité de matière (mol)
n = 158 *0,010 = 1,58 ~1,6 g.
|
On dose
la solution de permanganate de potassium par pesée d'oxalate de sodium
Na2C2O4 en milieu acide sulfurique.
Ecrire la
demi équation correspondant au couple MnO4-aq / Mn2+aq.
2 fois
{ MnO4-aq + 8H+aq + 5e-
= Mn2+aq +4H2O }.
Ecrire la demi
équation correspondant au couple CO2 aq / C2O4-aq.
5 fois
{C2O42-aq
=2 CO2 aq + 2e-}.
Ecrire
l'équation de la réaction du permanganate sur l'oxalate.
2MnO4-aq +
16H+aq +5C2O42-aq
= 10 CO2 aq + 2Mn2+aq +8H2O.
Ecrire la
relation du dosage à l'équivalence. En déduire la masse d'oxalate de
sodium ( M= 134,0 g/mol) pour avoir une chute de burette de 10 mL à 20
mL.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques : n(C2O42-) =2,5 n(MnO4-).
Volume de solution titrante 15 mL ( compris entre 10 et 20 mL)
(MnO4-) = 0,015*0,050 =7,5 10-4
mol ; n(C2O42-) =2,5*7,5 10-4 =1,875 10-3 mol.
m = n(C2O42-) M = 1,875 10-3*134 =0,2513 ~0,25 g.
On procède enfin au dosage de la
solution S de fer (II) par la solution de permanganate.
Ecrire l'équation de
ce dosage.
MnO4-aq +
8H+aq + 5e- = Mn2+aq +4H2O
5 Fe2+aq = 5 Fe3+aq + 5e-.
MnO4-aq +
8H+aq +5 Fe2+aq = 5 Fe3+aq
+Mn2+aq +4H2O.
Donner la
relation à l'équivalence et en déduire l'expression littérale de CFe en fonction de CMnO4- de la chute de la
burette ve et de la prise
d'essai E de la solution S.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques : n(Fe2+) =5 n(MnO4-).
CFe E =5 CMnO4- ve ; CFe =5 CMnO4- ve / E.
Préparations de
solutions tampon.
Vous avez
à votre disposition les solutions suivantes :
- acide acétique à environ 0,2 mol/L ; CH3COONa en solution à 0,2
mol/L
KH2PO4 solide ( M = 136 g/mol) ; Na2HPO4 en
solution à 0,2 mol/L ; solution de NH4Cl à environ 0,2 mol/L.
Solution d'acide chlorhydrique à 0,1 mol/L et à 0,2 mol/L.
Solution de soude à 0,1 mol/L et à 0,2
mol/L.
Solution d'ammoniac à 1 mol/L.
Les caractéristiques des couples acido-basiques sont données :
H3PO4 / H2PO4-
: pKa1 = 2,1 ; H2PO4-
/ HPO42- : pKa2 =
7,2 ; HPO42-
/ PO43- : pKa3 =
12,4 ;
NH4+ / NH3 : pKa =
9,25 ; CH3COOH / CH3COO- : pKa
= 4,75.
Comment
préparer rapidement et simplement une solution tampon de pH voisin de 9
?
La solution préparée ne sera pas trop diluée et son volume sera compris
entre 50 et 100 mL environ.
NH4+
/ NH3 : pKa = 9,25 ; les quantités de matière
d'ion ammonium et d'ammoniac doivent être à peu près identiques.
50 mL de solution
de NH4Cl à environ 0,2 mol/L : n(NH4+) =50*0,2 =10 mmol.
10
mL de solution d'ammoniac à 1 mol/L : n(NH3) = 10 * 1 =10 mmol.
Comment
pourrait-on opérer pour ajuster la valeur de ce tampon à 10 ?
pH = 9,25 + log ( [NH3]
/ [NH4+]
).
En ajoutant de la solution d'ammoniac à 1 mol/L, le pH va croître
lentement.
Titrage
d'une solution contenant du chlorure de sodium ( Na+
+ Cl-) à environ 0,4
mol/L et de l'acide chlorhydrique ( H3O+ +
Cl-) à environ 0,1
mol/L.
On dispose de la verrerie de laboratoire usuelle ainsi que du matériel
physico-chimique suivant : pHmètre, conductimètre, millivoltmètre,
électrodes.
Les solutions qui sont à votre disposition sont les suivantes :
hydroxyde de sodium à 0,200 mol/L et solution de nitrate d'argent à
0,050 mol/L
Donner le
protocole du titrage pour déterminer le titre exact en acide
chlorhydrique et en chlorure de sodium.
Titrage acide base avec suivi pHmétrique pour déterminer le titre en
acide chlorhydrique.
H3O+aq + HO- aq = 2H2O.
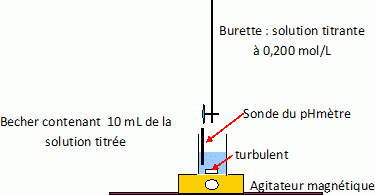
Tracer la courbe pH= f( volume ajouté ) pour déterminer l'équivalence.
A l'équivalence Cacide = 0,200 Vajouté à l'équivalence
/ 10.
|
Titrage par précipitation avec suivi
conductimétrique pour déterminer le titre total en ion chlorure.
Ag+aq + Cl- aq = AgCl(s).
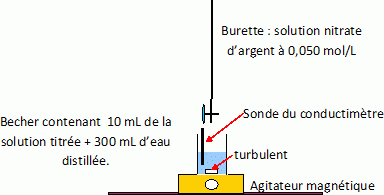
Tracer
la courbe conductivité = f( volume ajouté ). Cette courbe est
constituée de deux segments de droites ; leur intersection donne le
volume équivalent Véqui.
Cchlorure totale = 0,050 Vajouté à l'équivalence / 10.
Cchlorure de sodium = Cchlorure
totale - Cacide.
|
|
|
|

