Préparation
d'une solution d'hydrogénophtalate de potassium.
Préparation d'une solution d'hydrogénophtalate de potassium de
concentration voisine de 0,100 mol/L mais connue avec précision.
L'hydrogénophtalate
de potassium, de formule C8H5O4K de
masse molaire M= 204,18 g/mol, cristallise sans aucune molécule d'eau.
Etablir la liste du
matériel nécessaire.
Balance
de précision, coupelle, spatule.
Fiole jaugée de 100,0 mL, entonoir et pissette d'eau distillée.
Calculer la masse
d'hydrogénophtalate de potassium à peser pour préparer 100 mL
de solution aqueuse de concentration 0,100 mol/L.
Quantité de matière (mol) = concentration ( mol/L) fois volume (L)
n = 0,100*0,100 = 1,00 10-2 mol.
Masse (g) = masse molaire ( g/mol) * quantité de matière ( mol)
m = M n = 204,18 *1,00 10-2 = 2,04 g.
Peser à la balance de précision une masse voisine de m, noter la valeur
réellement pesée et calculer la concentration CA de la
solution préparée.
Si m = 2,10 g : n = 2,10 / 204,18 = 1,03 10-2 mol et CA
= 1,03 10-2 / 0,100 = 0,103 mol/L.
Vérification
de la concentration d'une solution de d'hydroxyde de sodium.
On dispose d'une solution d'hydroxyde de sodium de concentration CB
voisine de 0,1 mol/L. Sa concentration n'est pas rigoureusement connue
car la soude est un produit qui se carbonate très facilement à la
longue. Vous devez donc procéder à son étalonnage avec la solution
d'hydrogénophtalate de potassium préparée précédemment.
Etablir
la liste du matériel à rassembler pour réaliser le dosage de 10 mL de
solution d'hydrogénophtalate de potassium par la soude. On
utilisera la phénolptaléine comme indicateur coloré.
Burette graduée de 25 mL, erlenmeyer, agitateur magnétique et
turbulent, becher, pipette jaugée de 10,0 mL, indicateur coloré.
|
Réaliser la
manipulation et calculer la concentration réelle CB de la
soude sachant que la réaction se fait mole à mole.
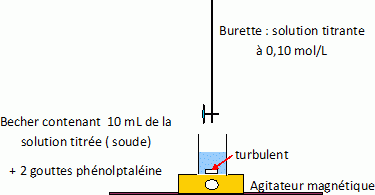
Quantité de matière d'hydroxyde de sodium ( soude ) : 10 CB
mmol
Quantité de matière d'hydrogénophtalate de potassium : Vajouté
*0,100 mmol.
10 CB
= Vajouté
*0,100 ; CB =Vajouté *0,100 / 10.
|
Mesure de la
conductivité s d'une solution
d'acide acétique.
On désire mesurer la conductivité s
d'une solution aqueuse d'acide acétique de concentration
en soluté apporté égale à 1,00 10-2 mol/L.
La conductivité est une grandeur caractéristique d'une solution
ionique. Pour une température donnée, elle dépend de la concentration
des ions sui la constituent et de leur conductivité molaire ionique.
Une solution de chlorure de potassium de conductivité connue sert de
solution étalon pour étalonner le conductimètre.
Manipulation :
A l'aide de la notice fournie et des valeurs de conductivités de la
solution étalon, étalonner le conductimètre.
Verser environ 50 mL de solution d'acide éthanoïque dans un becher et
mesurer la conductivité de la solution ainsi que sa température.
Préparation d'une solution d'hydroxyde de sodium.
On vous demande de réaliser 500 mL de solution d'hydroxyde de sodium de concentration molaire environ égale à cB
=0,10 mol/L et de donner son titre exact. Vous disposez pour cela
d'hydroxyde de sodium en perles de masse molaire M = 40 g/mol de pureté
99 %, d'une solution d'acide chlorhydrique de concentration molaire CA = 0,10 mol/L, de la verrerie de laboratoire usuelle.
Rappeler la formule statistique de l'hydroxyde de sodium.
NaOH.
Le flacon porte l'étiquette avec les indications suivantes : R : 35 ; S : 26-37 / 39- 45 R : 35 ; S : 26-37 / 39- 45
Indiquer la signification de ce pictogramme.
Substance corrosive.
Que signifient les lettres R et S ?
R : réactif ; risque ; remède. S : solvant ; sécurité ; sensibilité.
Quelles précautions faut-il prendre lors de l'utilisation de l'hydroxyde de sodium ?
Port de blouse, gants et lunettes de sécurité.
Calculer la masse d'hydroxyde de sodium nécessaire pour réaliser la solution demandée.
Quantité de matière (mol) = concentration ( mol/L) fois volume (L)
n = 0,10*0,500 = 5,0 10-2 mol.
Masse (g) = masse molaire ( g/mol) * quantité de matière ( mol)
m = M n = 40 *5,0 10-2 = 2,0 g.
Tenir compte de la pureté : 2,0 / 0,99 =2,02 ~2,0 g.
Décrire précisément le protocole.
Placer une coupelle sur la balance électronique, appuyer sur "tare" puis éventellement sur "zéro".
A l'aide d'une spatule, prélever deux grammes de solide.
Placer un entonnoir sur la fiole jaugée de 500 mL, y verser le solide,
rincer coupelle et entonnoir. L'eau de rinçage se retrouve dans la
fiole jaugée.
Compléter la fiole jaugée avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter pour rendre homogène.
Dosage de la solution d'hydroxyde de sodium.
Pour donner le
titre exact de la solution d'hydroxyde de sodium préparée vous allez
effectuer le titrage par une solution d’acide chlorhydrique à 0,10
mol/L.
Etablir la liste de matériel pour réaliser le dosage de 10 mL de solution d’hydroxyde de sodium par la solution d’acide.
Burette graduée de 25 mL, erlenmeyer, agitateur magnétique et
turbulent, becher, pipette jaugée de 10,0 mL, indicateur coloré.
Quel indicateur de fin de réaction doit-on choisir parmi ceux proposés ci-dessous ?
indicateur
|
héliantine
|
bleu de bromothymol
|
phénolphtaléine
|
zone de virage
|
3,1- 4,4
rouge - orange
|
6,0 - 7,6
jaune - bleu
|
8,2 - 9,8
incolore - rose
|
La
zone de virage de l'indicateur coloré doit contenir la valeur du pH au
point équivalent ( pH= 7 dans le cas d'un dosage soude- acide
chlorhydrique ) : donc bleu de bromothymol.
Déterminer la concentration molaire de la solution d'hydroxyde de sodium.
La réaction se fait mole à mole.
Quantité de matière d'hydroxyde de sodium ( soude ) : 10 CB
mmol
Quantité de matière d'acide chlorhydrique : Vajouté à l'équivalence
*0,10 mmol.
10 CB
= Vajouté à l'équivalence
*0,10 ; CB =Vajouté à l'équivalence
*0,10 / 10.
Titrage d'une solution contenant du chlorure de sodium ( Na+ + Cl-) à environ 0,4 mol/L et de l'acide chlorhydrique ( H3O+ + Cl-) à environ 0,1 mol/L.
On dispose de la verrerie de laboratoire usuelle ainsi que du matériel
physico-chimique suivant : pHmètre, conductimètre, millivoltmètre,
électrodes.
Les solutions qui sont à votre disposition sont les suivantes :
hydroxyde de sodium à 0,200 mol/L et solution de nitrate d'argent à
0,050 mol/L
Donner le protocole du titrage pour déterminer le titre exact en acide chlorhydrique et en chlorure de sodium.
Titrage acide base avec suivi pHmétrique pour déterminer le titre en acide chlorhydrique.
H3O+aq + HO- aq = 2H2O.
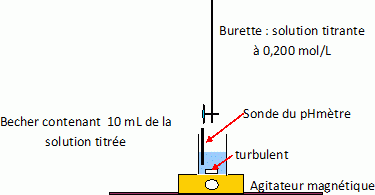
Tracer la courbe pH= f( volume ajouté ) pour déterminer l'équivalence.
A l'équivalence Cacide = 0,200 Vajouté à l'équivalence / 10.
|
Titrage par précipitation avec suivi conductimétrique pour déterminer le titre total en ion chlorure.
Ag+aq + Cl- aq = AgCl(s).
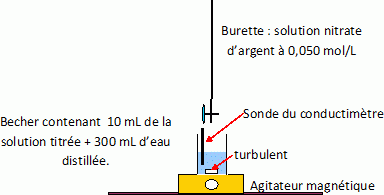
Tracer
la courbe conductivité = f( volume ajouté ). Cette courbe est
constituée de deux segments de droites ; leur intersection donne le
volume équivalent Véqui.
Cchlorure totale = 0,050 Vajouté à l'équivalence / 10.
Cchlorure de sodium = Cchlorure totale - Cacide.
|
|
|
|

 R : 35 ; S : 26-37 / 39- 45
R : 35 ; S : 26-37 / 39- 45
