Le vert de bromocrésol est un indicateur
coloré acido-basique. C'est un couple acide-base dont
l'acide noté HInd et la base notée
Ind- possèdent deux couleurs
différentes : la forme acide est jaune tandis que la
forme basique est bleue. Le but de cet exercice est de
déterminer la valeur de la constante d'acidité
du vert de bromocrésol par deux méthodes
différentes.
Écrire l'équation de la réaction
de l'acide HInd avec l'eau.
HInd aq+ H2O(l) = Ind-
aq +H3O+aq (1)
Donner les couples acide / base mis en jeu.
HInd aq / Ind-
aq et H3O+aq / H2O(l)
Donner
l'expression de la constante d'équilibre de cette réaction et la
comparer à la constante d'acidité Ka du couple de l'indicateur coloré.
Expression de la constante d'acidité
Ka de l'indicateur en fonction du pH de la
solution et de la concentration molaire en soluté
apporté c de la solution S :
Ka
=[Ind-]éq[H3O+]éq/[HInd
]éq avec
[Ind-]=[H3O+]
= 10-pH ;
Expression de la constante d'équilibre de (1) :
K =Ka
=[Ind-]éq[H3O+]éq/[HInd
]éq.
On considère qu'un indicateur coloré prend sa teinte acide lorsque [HInd
]éq / [Ind-]éq>10 et qu'il prend sa teinte basique lorsque [Ind-]éq / [HInd
]éq>10.
Déterminer en fonction du pKa, l'intervalle de pH délimitant la zone de virage de l'indicateur coloré.
pH=pKa + log ( [Ind-]éq / [HInd
]éq ) ; log ( [Ind-]éq / [HInd
]éq ) = pH-pKa avec log 10 = 1 et log (1/10 )= -1
teinte acide si log ( [Ind-]éq / [HInd
]éq )< -1 : pH < pKa-1.
teinte basique si log ( [Ind-]éq / [HInd
]éq )>1 : pH > pKa+1.
zone de virage [ pKa-1 ; pKa+1].
|
Tracer le diagramme de prédominance des teintes du couple de l'indicateur coloré.
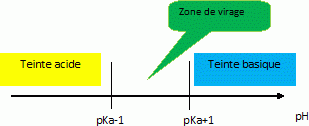
|
On
peut suivre l'évolution temporelle d'un système chimique contenant au
moins une espèce colorée en mesurant l'absorbance A du milieu
réactionnel.
La loi de beer Lambert s'écrit pour un système chimique contenant une seule espèce chimique colorée :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique)
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
e
(L mol-1
cm-1) est une caractéristique
de la molécule. Plus e
sera grand, plus la solution absorbe.
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Dans le cas de plusieurs espèces chimiques colorée : A = S eilci.
Donner en justifiant l'unité du coefficient d'extinction molaire.
e= A / (lc) ; A est sans unité ; l est en cm et C en mol/L d'où e
(L mol-1
cm-1).
On considère une solution où les seules espèces absorbantes sont HInd et Ind-.
Donner l'expresion de l'absorbance A de la solution.
A =eHInd l [Hind]éq + eInd- l [Ind-]éq ;
Dans une solution de concentration molaire volumique C en indicateur coloré apporté,
exprimer la concentration [Ind-]éq en fonction de [Hind]éq et C.
Conservation de la matière Ind : C =[Ind-]éq+[Hind]éq .
[Ind-]éq=C-[Hind]éq .
On mesure à la longueur d'onde lmax les absorbances A1, A2, A3 de trois solutions S1, S2, S3 de même concentration C en indicateur coloré apporté mais de pH différents et donc de concentration molaire volumique [Hind]éq et [Ind-]éq différentes.
Le pH de la solution S1 étant élevé, la concentration [Hind]éq peut être considérée comme nulle.
Donner l'expression de l'absorbance A1 en fonction de eInd- , l et C.
A1= eInd- l [Ind-]éq ;
[Ind-]éq= C-[Hind]éq ~C ; A1= eInd- l C.
Le pH de la solution S2 étant faible, la concentration [Ind-]éq peut être considérée comme nulle.
Donner l'expression de l'absorbance A2 en fonction de eHInd , l et C.
A2= eHInd l [Hind]éq ; [Hind]éq ~C ; A2= eHInd l C.
Le pH de la solution S3 est tel que l'on ne peut négliger ni [Ind-]éq ni [Hind]éq.
Donner l'expression de l'absorbance A3 en fonction de A1, A2, C, [Hind]éq et [Ind-]éq.
A3 =eHInd l [Hind]éq + eInd- l [Ind-]éq ;
eInd- = A1 / (lC) et eHInd =A2 / (lC).
A3=A2[Hind]éq / C +A1 [Ind-]éq /C =(A2[Hind]éq +A1 [Ind-]éq ) / C.
Exprimer la constante d'acidité Ka puis le pKa du couple de l'indicateur coloré en fonction du pH de la solution S3 et des absorbances A1, A2, A3.
Ka
=[Ind-]éq [H3O+]éq / [HInd
]éq ;
A3=(A2[Hind]éq +A1 [Ind-]éq ) / C et
[Ind-]éq=C-[Hind]éq .
A3 C=A2[Hind]éq +A1 (C-[Hind]éq) ; A3 C - A1 C = [Hind]éq (A2 -A1 ) ;
[Hind]éq = C (A3 -A1 ) / (A2 -A1) .
[Ind-]éq=C-[Hind]éq = C( 1 -(A3 -A1 ) / (A2 -A1)) = C (A2 -A3 ) / (A2 -A1)
[Ind-]éq / [HInd
]éq = (A2 -A3 ) / (A3 -A1 )
Ka = [H3O+]éq(A2 -A3 ) / (A3 -A1 ) = 10-pH (A2 -A3 ) / (A3 -A1 )
pKa = - log Ka = pH-log ((A2 -A3 ) / (A3 -A1 ))
A.N : A1 = 0,95 ; A2 = 0,02 ; A3 = 0,75 ; pH = 5,3.
pKa = 5,3 - log ( 0,73 / 0,20) = 4,7.
