Données :
masse volumique de l’éthanol r
= 7,9 102 kg m-3 ;
volume molaire Vm=24 L/mol à 293 K sous 101 325 Pa.
F = 96500 C
mol-1 ; NA= 6,02 1023 mol-1
;
R = 8,314 J K-1 mol-1 ; e = 1,6 10-19
C.
Entropie molaire standard absolue à 1033 K en J mol-1K-1.
H2O(g) :
226 ; H2(g) : 165 ; CO2(g) :
269 ;
CH4(g) : 215.
Approche
historique.
dates
|
découvertes
scientifiques
|
1690
|
La
machine à vapeur de Denis Papin
|
1769
|
Premier
véhicule automobile à vapeur
|
1779
|
Conservation de la matière ( Lavoisier)
|
1800
|
La pile voltaïque
|
1821
|
La rotation magnétique ( Faraday)
|
1836
|
La
pile Daniell
|
1839
|
La pile à combustible
|
1874
|
Premier
moteur à explosion à 4 temps
|
1884
|
Première
voiture à essence
|
1888
|
invention
du pneumatique
|
1899
|
invention
de la boïte à vitesse
|
1900
|
invention
du moteur Diesel
|
1910
|
invention
du pare-brise |
1914
|
invention
de l'avertisseur sonore ( Klaxon) |
1947
|
le transistor
|
1968
|
invention
de l'airbag
|
1970
|
le microprocesseur
|
1970
|
la
direction assistée
|
2000
|
ordinateur
de bord et GPS en série sur de nombreux véhicules
|
|
La
pile à combustible est une pile électrique alimentée constamment en
réactifs. Elle est constituée de deux électrodes séparées par un
électrolyte, qui peut être solide ou liquide.
Etude
de la pile dihydrogène- dioxygène.
Les réactifs sont le dioxygène et le dihydrogène gazeux. Les électrodes
sont recouvertes de platine ou de ruthénium et l'électrolyte est une
membrane échangeuse de protons. Les couples intervenant dans la pile
sont : H+aq / H2(g) et O2(g)/H2O(l).
Le schéma ci-dessous illustre le principe de fonctionnement de la pile :
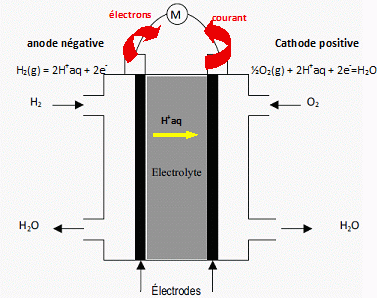
|
Donner l'équation
chimique de la réaction mise en jeu au cours du fonctionnement de la
pile.
H2(g) +½O2(g) = H2O(l)
On appelle combustible le réactif oxydé. Nommer le réactif
constituant le combustible.
H2 est oxydé, il constitue le combustible.
Par
opposition à "combustible" comment nomme t-on l'autre type de réactif
?
Le dioxygène constitue le comburant.
Indiquer
le rôle du platine ou du ruthénium déposé sur les électrodes.
Le platine joue le rôle de catalyseur : il accélère la réaction
d'oxydation du dihydrogène.
Un des réactifs est limitant. Lequel ? Justifier.
Le dioxygène est issu de l'air, sa quantité est quasiment illimitée. Le
dihydrogène constitue le réactif limitant.
On estime à 3 kg la masse de dihydrogène nécessaire pour qu'une voiture
parcourt 500 km. On suppose que le dihydrogène est un gaz parfait.
Calculer
le volume de dihydrogène correspondant à T = 293 K et P = 101 325
Pa.
V = nRT / P avec n = m/M = 3000/2 = 1500 mol.
V = 8,314*293*1500/101 325 = 36 m3.
Proposer
un moyen permettant de réduire l'espace occupé par ce gaz à température
ambiante.
Le dihydrogène doit être comprimé et stocké dans des bouteilles en
acier.
Etude de
la production de dihydrogène.
Dans la nature le dihydrogène n'est pas directement
disponible. Il est produit principalement par reformage de combustibles
fossiles ou par électrolyse de l'eau. Le principal procédé est le
vaporeformage du méthane sous l'effet de la vapeur d'eau. Lors de ce
procédé, deux réactions en milieu gazeux se produisent successivement :
- le méthane réagit avec de l’eau, à température élevée et sous pression élevée, en présence d’un catalyseur,
selon la réaction d’equation
:
CH4 + H2O = CO
+ 3H2 (1) ΔrH1° (760°C) =
249 kJ.mol-1
- le
monoxyde de carbone réagit avec la vapeur
d’eau pour produire
du
dioxyde de carbone et du dihydrogène, selon la réaction d’équation
:
CO + H2O = CO2 + H2 (2) ΔrH2° (760°C) =
-32 kJ.mol-1.
Indiquer
qualitativement l'influence d'une élévation de température à pression
constante et en système fermé :
- pour
l'équilibre (1) seul,
Une réaction endothermique est favorisée par une élévation de
température ; une augmentation de température déplace l'équilibre 1
dans le sens direct.
-
pour l'équilibre (2) seul.
Une réaction exothermique est
défavorisée
par une élévation de température ; une augmentation de température
déplace l'équilibre 2 dans le sens inverse
Indiquer qualitativement l'influence d'une élévation de pression à
température constante et en système fermé :
- pour
l'équilibre (1) seul,
A partir de deux molécules initiales, on forme 4 molécules : le nombre
total de molécules augmente au cours de la réaction dans le sens
direct, celle-ci est défavorisée par une augmentation de pression.
- pour
l'équilibre (2) seul.
Le nombre total de molécules ne change pas : une augmentation de
pression est sans influence.
La réaction de reformage se déroule à 760°C sous une pression de 33
bars On considère, dans cette question, la réaction de reformage en
phase gazeuse :
CH4(g) + 2 H2O(g) = CO2(g) + 4 H2(g) (3)
Calculer ΔrG3°,
l’enthalpie
libre standard de
réaction
à
760 °C.
(3) est obtenue en ajoutant (1) et (2) : ΔrH3° =ΔrH1°
+ΔrH2° =
249-32=217 kJ mol-1.
ΔrS3° =S°(CO2(g)) +4 S°(H2(g))
– 2S°(H2O(g) )-S°(CH4(g))
ΔrS3° =269 + 4*165-2*226-215 =262 J mol-1 K-1.
ΔrG3°= ΔrH3°-TΔrS3° =217 000-(760+273) *262 =-53646 ~-54 kJ mol-1.
Calculer
K°3,
la
constante d'équilibre
à
760 °C.
ΔrG3°= -RT lnK°3 ; lnK°3 = ΔrG3°/( -RT ) = 53646
/(8,314*1033) =6,25 ; K°3 =516 ~5,2 102.
Justifier
l'intérêt
de travailler en excès de vapeur d'eau.
Un réactif en excès ( le moins
onéreux) déplace l'équilibre dans le sens direct.
Ces
réactions
sont conduites en présence d'un catalyseur solide à base d'oxyde de
nickel
NiO.
Préciser
de quel type de catalyse il s’agit.
Le catalyseur est un solide ; les réactifs sont gazeux : la catalyse
est hétérogène.
Indiquer
sous quelle forme doit être introduit ce catalyseur pour que son
efficacité soit
optimale.
Les réactifs sont adsorbés à la surface du catalyseur : la surface de
ce dernier doit être la plus grande possible ( poudre, solide poreux )
Le
rendement thermodynamique est-il modifié par la présence du catalyseur
?
Le catalyseur accélère la réaction mais ne modifie pas la composition
du mélange réactionnel à l'équilibre.
Dans
le cas ou la réaction de reformage : CH4
+
2 H2O
= CO2
+
4 H2
est
totale.
Calculer,
en mol, la quantité maximale de méthane consommée et la quantité
maximale de CO2
dégagée pour
parcourir 500 km.
On
estime à 3 kg la masse de dihydrogène nécessaire
pour qu’une voiture parcourt 500 km.
Quantité de matière de dihydrogène : 3000 / 2 = 1500 mol.
D'après les nombres stoechiométriques de l'équation ci-dessus : n(CH4)
=n(CO2)
= 0,25 n(H2)
= 1500 / 4 = 375 mol ~3,8 102 mol.
Etude de
la pile méthanol-dioxygène.
L'utilisation du
dihydrogène étant délicate, les recherches portent actuellement sur le
développement de la pile à méthanol.
Donner la
formule semi-développée du méthanol. Donner
le nom de la famille chimique à laquelle il appartient. Nommer le
groupe
caractéristique correspondant à sa fonction.
H-CH2-OH : alcool
primaire ; le groupe caractéristique est le groupe "hydroxy" OH, fixé
sur un atome de carbone tétragonal.
Dans cette pile se produisent deux réactions électrochimiques aux
électrodes dont les équations sont les suivantes :
-
A
l’anode : CH3OH(g)+ H2O
(g) --> CO2(g)
+ 6H+ +6e-. (4)
-
A la
cathode : O2(g) +4H+ +4e- --> 2H2O
(g). (5)
Indiquer
en justifiant, laquelle de ces réactions est une oxydation. Indiquer si le
méthanol est un oxydant ou un réducteur.
Un réducteur, le méthanol, cède des électrons et s'oxyde : (4) est une
oxydation.
Donner
l'équation de la réaction mise en oeuvre lors du fonctionnement de la
pile.
2 fois { CH3OH(g)+
H2O (g) -->CO2(g)
+ 6H+ +6e- }
3 fois {
O2(g) +4H+ +4e- --> 2H2O
(g) }
2 CH3OH(g)+
2 H2O (g) + 3O2(g) +12H+ +12e-
-->2 CO2(g)
+ 12 H+
+12 e- +6 H2O
(g)
2 CH3OH(g+
3O2(g) --> 2 CO2(g)
+ 4 H2O (g)
La
pile méthanol - dioxygène peut débiter un courant d'intensité 100 A. En
supposant le rendement de la pile égal à 100 %,
calculer
pour un volume de méthanol de 30 L, la durée de fonctionnement de cette
pile.
M(méthanol) = 12+4+16 =32 g/mol.
masse de méthanol (g) = volume (L) * masse volumique ( g/L) ; m = 30 *
790 =23700 g
Quantité de matière de méthanol : n = m/M =23700 / 32 =740,63 mol
Quantité de matière d'électrons : n(e-) = 6 n(méthanol) =
6*740,63=4443,75 mol
Quantité d'électricité : Q =n(e- ) F = 4443,75 *96500 =4,288
108 C
Durée de fonctionnement : t = Q/ I = 4,288 108 / 100 = 4,288
106 s ~ 1,2 103 heures.
Indiquer l'impact
respectif d'une pile à dihydrogène - dioxygène et d'une pile méthanol-
dioxygène sur l'effet de serre.
La pile dihydrogène - dioxygène ne rejette pas de dioxyde de carbone.
La pile méthanol- dioxygène rejette du dioxyde de carbone et contribue
à l'effet de serre.
Indiquer
le danger représenté par l'utilisation du dihydrogène dans un véhicule.
Le mélange dihydrogène air est explosif pratiquement en toutes
proportions.
|
Etude d'un
biocarburant : l'éthanol.
Données : énergie de liaison en kJ/mol à 25 °C pour des composés à
l'état gazeux.
D(C-H) = 410 ; D(C-C) = 348 ; D(C-O) = 356 ; D(O-H) = 460 ; D(O=O) dans
O2 = 494 ; D(C=O) dans CO2 = 795.
Pouvoir calorifique inférieur PCI de l'essence : Pessence =
45,0 MJ kg-1.
Masse volumique de l'essence r
=734 kg m-3.
Les
biocarburants issus des cultures végétales sont une alternative aux
énergies fossiles actuellement utilisées. L'importance de leur pouvoir
calorifique en fait des candidats potentiels pour remplacer
efficassement l'essence.
L'éthanol de formule brute C2H6O est un alcool
primaire directement issu, par exemple, des cultures de betteraves à
sucre ou de blé, après fermentation des sucres.
Donner
la formule semi-développée de l'éthanol en indiquant la fonction alcool.
CH3-CH2OH : le groupe hydroxy OH lié à un atome
de carbone tétragonal constitue la fonction alcool.
Justifier
que l'éthanol est un alcool primaire.
Le carbone porteur du groupe hydroxy est lié à un seul autre atome de
carbone.
Donner
la formule semi-développée et le nom :
d'un
alcool secondaire : CH3-CH OH -CH3
propan-2-ol ;
d'un
alcool tertiaire : (CH3)3 C -OH :
2,2-diméthylpropan-2-ol.
On désire utiliser l'énergie libérée par
la combustion complète de l'éthanol dans le dioxygène de l'air pour
alimenter le moteur thermique d'une automobile. l'équation de la
réaction de la combustion complète de l'éthanol est :
C2H6O(g) + 3 O2(g) → 2 CO2(g) + 3 H2O(g).
Calculer l'énergie
libérée lors de la combustion complète dans le dioxygène de l'air d'une
mole d'éthanol gazeux.
Liaisons rompues : 2 C-C ; 5 C-H ; C-O;
O-H et 3 O=O.
Liaisons créées : 4 C=O et 6 H-O.
E = 2 D(C-C) + 5 D(C-H) + D(C-O) +3 D(O=O) -4 D(C=O) - 5D(O-H)
E =2*348 +5*410+356+3*494-4*795-5*460
E = 696+ 2050+356+1482-3180-2300 = -896 kJ/mol.
On appelle pouvoir calorifique inférieur
( PCI), l'énergie dégagée sous forme de chaleur par la combustion d'une
unité de masse de carburant gazeux ( 1 kg) dans des conditions
standardisées.
Calculer le PCI de
l'éthanol.
Quantité de matière d'éthanol n = m/M = 1000/46 = 21,74 mol.
PCI = 896 *21,74 =1,95 104 J kg-1 ~ 19,5 MJ kg-1.
Pour parcourir 500 km, un véhicule consomme 42,3 kg d'éthanol.
Calculer
la masse de CO2 rejeté.
n(éthanol) =m / M = 42300 / 46 = 9,196 102 mol
n(CO2) = 2n(éthanol)
= 2*9,196 102
=1,84 103 mol.
Masse de CO2 rejeté : m = n(CO2) M(CO2) =1,84 103 *44 =8,1 104
g = 81 kg.
Lors de la croissance des plantes ( betteraves, blé), celles-ci fixent
du dioxyde de carbone. La
combustion de l'éthanol issu de ces mêmes plantes, libère du dioxyde de
carbone : le bilan carbone est nul. |
