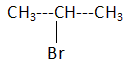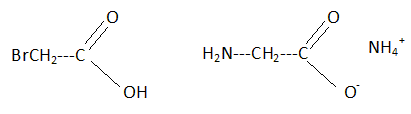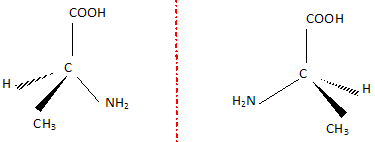Réactions
d'addition :
Donner la
formule semi-développée du 2-bromopropane.
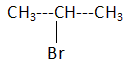
Parmi
les propositions ci-dessous, quel(s) est (sont) celui (ceux) qui
convient ( conviennent ) pour
traduire la relation existant entre le 2-bromopropane et le
1-bromopropane. Justifier.
Isomères de fonction, isomères de constitution, énantiomères,
diastéréoisomères.
Isomères de constitution : l'atome de brome est porté par le carbone 1
ou le carbone 2.
L'addition de bromure d'hydrogène sur le propène conduit au
2-bromopropane.
Donner le
mécanisme en discutant de l'orientation de l'addition.
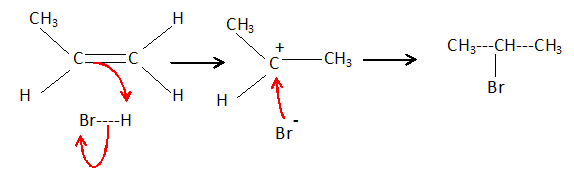
L'étape
déterminante est la formation du carbocation secondaire, plus stable
qu'un carbocation primaire. Le 2-bromopropane est
le produit majoritaire.
L'addition
de bromure d'hydrogène HBr sur le propène en présence de peroxyde de
benzoyle ( C6H5CO-O-O-COC6H5)
conduit au 1-bromopropane.
Donner
le mécanisme en discutant de l'orientation de l'addition. (effet Karasch )
C6H5CO-O-O-COC6H5 --> 2C6H5CO-O..
C6H5CO-O.+ HBr --> C6H5CO-OH + Br..
CH3-CH=CH2 + Br.--> CH3-.CH-CH2Br ( formation du radical le plus stable)
CH3-.CH-CH2Br + HBr --> CH3-CH2-CH2Br + Br..
|
Réations
d'élimination.
La déshydrobromation à
température élévée du 3-bromo-3-méthylpentane en présence d'ion
hydroxyde conduit à un mélange de trois produits dont les formules
topologiques sont indiquées ci-dessous :
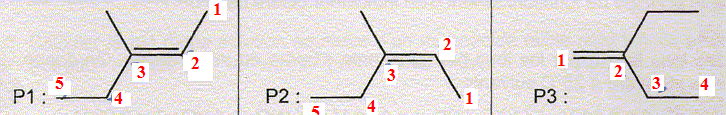
|
Donner les
noms des 3 produits.
P1
: (E) 3-méthylpent-2-ène ; P2
: (Z) 3-méthylpent-2-ène ; P3
: 2-éthylbut-1-ène.
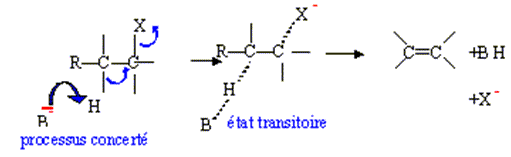
Il existe des éliminations E1 et E2.
Définir
ces éliminations puis identifier en justifiant le type d'élimination
pour le 3-bromo-3-méthylpentane en présence d'ion hydroxyde à
température élevée.
Elimination E2
bimoléculaire :
Elimination E1
monomoléculaire :
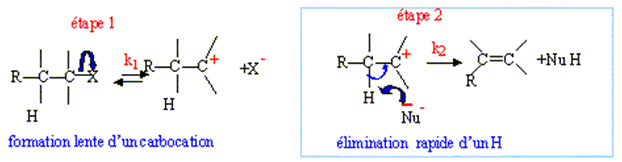
Pour le
3-bromo-3-méthylpentane, l'élimination E1
conduit à un carbocation tertiaire, particulièrement stable.
Donner le
méanisme de la réaction et expliquer la formation des trois
produits.
Il y a trois atomes d'hydrogène différents en position béta.
La base peut attaquer l'un ou l'autre de ces atomes, ce qui conduit à 3 produits.
Pourquoi
P1 et P2 sont-ils obtenus
majoritairement ?
Lorsque
la base a le choix entre deux hydrogènes en position béta,
c'est l'alcène le plus substitué qui est le produit prédominant de
l'élimination ( règle de Saytzev)
P1
est en quantité plus importante que P2 : pourquoi
?
L'isomère Z, du fait de l'encombrement stérique, est moins stable que l'isomère E.
Parmi les
propositions ci-dessous, quel(s) est (sont) celui (ceux) qui convient (
conviennent ) pour
traduire la relation existant entre P1
et P2. Justifier.
Isomères de fonction, isomères de constitution, énantiomères,
diastéréoisomères.
isomères de constitution, diastéréoismères ( isomérie de type Z E ).
Amino-acides et peptides.
On se propose de faire la synthèse du plus simple des amino-acides, l'acide aminoéthanoïque de formule H2N-CH2-COOH encore appelé glycine.
On fait agir du dibrome en présence de phosphore sur l'acide éthanoïque. On obtient un produit A de formule C2H3O2Br.
A est mis en présence d'un excès d'ammoniac à 50 °C, on isole un produit B de formule brute C2H8O2N2. ( B est un sel d'ammonium ).
B est ensuite acidifié et on obtient la glycine.
Ecrire les formules semi-développées de A et B.
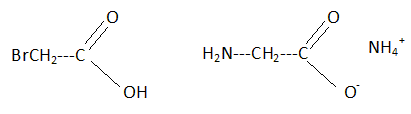
Donner
la formule semi-dévelppée d'une liaison peptidique puis citer un
exemple ( hormis peptide ) de molécule du vivant contenant des liaisons
peptidiques.
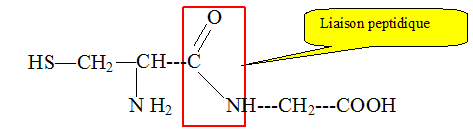
Dans les protéines, les acides aminés sont reliés par des liaisons peptidiques.
|
Erire
les réactions de formation ( en utilisant les formules semi-développées
) des 4 dipeptides que l'on peut former à partir d'un mélange de
glycine et d'alanine ( acide 2-aminopropanoïque ).
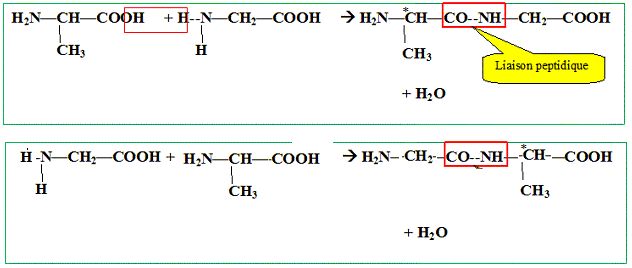
Chaque dipeptide possède un carbone asymétrique : il y a donc deux couples d'énantiomères.
L'alanine présente deux stéréoisomères.
Pourquoi ? Les représenter en représenation de Cram et indiquer le type de stéréoisomères.
La présence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères.
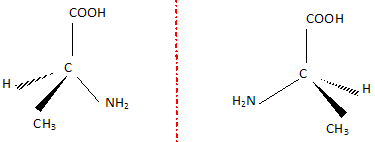
|