Quelques
définitions.
Définir
d'après le modèle de Brönsted :
acide
: espèce susceptible de libérer un proton H+ ; base :
espèce susceptible de gagner un proton H+.
couple
acide base : deux espèces notées AH et A-
constituent un couple acide base s'il existe entre elles une relation
du type :
AH = A- + H+.
ampholyte
ou amphotère : l'eau, l'ion hydrogénocarbonate peuvent se
comporter comme un acide ou comme une base : ce sont des ampholytes.
Ecrire
l'équation de la réaction traduisant l'équilibre d'autoprotolyse de
l'eau en spécifiant les couples acide / base.
Couples H3O+
aq / H2O(l) et H2O(l) / HO-aq.
2 H2O(l)= HO-aq + H3O+
aq
Comment
montrer expérimentalement l'existence de cette autoprotolyse ?
Mesurer la conductivité de l'eau pure : la valeur trouvée n'est pas
nulle. Il existe donc des ions en solution.
Donner la
définition du pH d'une solution aqueuse diluée.
Le pH est égal à l'opposé du logaritme à base 10 de la
concentration en ion oxonium, exprimée en mol/L : pH= -log [H3O+
aq].
Indiquer
un autre solvant qui est le siège d'un équilibre d'autoprotolyse ;
indiquer les couples acide base mis en jeu.
Couples NH4+ / NH3
et NH3 / NH2-.
2NH3 = NH4+
+ NH2-.
Donner
les définitions respectives d'un acide et d'une base de Lewis
puis donner un exemple pour chaque définition.
acide
: espèce accepteur de doublets possédant une orbitale électronique vacante, AlCl3.
Base :
espèce donneur de doublet, possédant un doublet électronique disponible. NH3, HO- aq sont des bases de Lewis, et également des bases de Brönsted.
|
Solutions
aqueuse d'acide et de base.
L'introduction
d'un acide AH ou de la base conjuguée A- dans
l'eau peut conduire à trois situations différentes.
Décrire
ces trois situations en utilisant les adjectifs forte, faible,
indifférent et citer un exemple.
L'acide
chlorhydrique est un acide fort ; l'ion chlorure est indifférent du
point de vue acide base.
La
soude est une base forte : l'ion sodium est indifférent du point de vue
acide base.
L'ammoniac
est une base faible, l'acide conjugué est l'ion ammonium, un acide
faible.
l'acide
acétique est un acide faible ; sa base conjugée, l'ion acétate est une
base faible.
|
Quelle
est l'espèce chimique que l'on considère comme étant l'acide le plus
fort en solution aqueuse ? Même question pour l'espèce
basique la
plus forte.
H3O+ aq est l'acide le
plus fort en solution aqueuse ; HO-aq est la
base la plus forte en solution aqueuse.
Définir
la grandeur notée pKa d'un couple acide base.
Couple
acide base AH aq /A- aq : AH aq + H2O(l)
= A- aq + H3O+
aq.
La constante ( d'acidité Ka ) associée
à cet équilibre s'écrit ; Ka = [A-
aq] [H3O+ aq] / [AH aq
].
pKa = - log Ka.
Un acide fort a un pKa égal à 0 : à
concentration égale, un acide faible est d'autant plus fort que le pKa
du couple est proche de 0.
Une base forte a un pKa égal à 14 ( à
25°C) : à concentration égale, une base faible est d'autant
plus forte que le pKa du couple est proche de 14.
On donne le pKa de 4 couples acide base :
| couple
acide base |
pKa |
| couple 1 : CH3-COOH
/ CH3-COO-. |
4,75 |
| couple 2 : ClCH2-COOH
/ ClCH2-COO-. |
2,85 |
| couple 3
: CH3-CH2-NH3+
/ CH3-CH2-NH2. |
10,8 |
couple 4 : 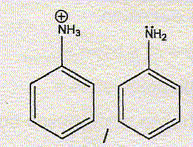 |
4,6 |
Identifier
parmi les 4 couple, le couple de l'aniline.
Couple n°4.
Comparer
la force de l'acide éthanoïque à celle de l'acide monochloroéthanoïque.
Justifier.
L'atome
de chlore électronégatif attire à lui les électrons
de
liaisons par effet inducteur : la charge de la base conjuguée
est mieux répartie ( moins localisée sur l'oxygène) ; la base,
l'ion monochloroacétate, est plus stable que la base, l'ion acétate : à
concentration égale, l'acide monochloroacétique est plus fort
que
l'acide acétique.
Comparer
la force de l'éthanamine à celle de l'aniline. Justifier.
Le
doublet de l'azote ( aniline) est délocalisé sur le cycle aromatique :
il est donc peu disponible. A concentration égale, l'aniline est une
base plus faible que l'éthanamine.
Calculer
le pH d'une solution aqueuse d'un acide fort noté HA de concentration
molaire c0=10-1 mol/L
puis c0 = 10-4 mol/L.
pH = - log c0
; -log 10-1 = 1 ; -log 10-4
= 4.
Calculer
le pH d'une solution aqueuse d'un acide faible noté HA ( pKa
= 3,6 ) de concentration molaire c0=10-1 mol/L
puis c0 = 10-4 mol/L.
On suppose que le volume de la solution st 1 L. Ka
= [A- aq] [H3O+
aq] / [AH aq ] = x2f / (c0-xf)
ave xf : avancement final.
10-3,6 = 2,5 10-4 (c0-xf)
= x2f ; x2f
+2,5 10-4 xf
- 2,5 10-4 c0.
D =
(2,5 10-4)2+4*2,5 10-4 c0.
si c0 = 0,1 : D =6,25 10-8
+10-4 ~10-4
; xf = (-2,5 10-4 +0,01)
/2 = 4,87 10-3 ; pH = -log(4,87 10-3)
=2,3.
si c0 = 10-4 : D =6,25 10-8
+10-7 ~10-4
; xf = (-2,5 10-4 +4,0
10-4) /2 = 7,65 10-5
; pH = -log(7,65 10-5)
=4,1.
Un volume V0
d'une solution aqueuse d'acide éthanoïque est dosée par une solution
aqueuse d'hydroxyde de sodium. Lors du dosage, on mesure le pH de la
solution à l'aide d'un pHmètre. les résultats expérimentaux
sont
rassemblés dans le tableau suivant :
| VNaOH
( mL) |
0 |
1,00 |
3,00 |
6,00 |
9,00 |
9,50 |
9,90 |
10,00 |
10,10 |
11,00 |
| pH |
2,9 |
3,8 |
4,4 |
5,0 |
5,8 |
6,1 |
6,8 |
8,7 |
10,7 |
11,7 |
Qu'est ce
q'un pHmètre ?
On dispose d’un capteur de pH constitué d'une électrode de verre et d'une
électrode au calomel. On montre que lorsque ces deux électrodes sont plongées
dans une solution aqueuse, on obtient une pile dont la force électromotrice E
dépend de la concentration en ion hydronium [H3O+] de la
solution.
Un pH-mètre. Il est composé de trois étages :
- mesure de la f.é.m. du capteur,
- amplification de la f.é.m. par un montage amplificateur,
- décalage de la tension obtenue en vue d’une lecture directe du pH.
Il faut étalonner le pHmètre en utilisant deux solutions tampon
( pH=4 et pH=7 par exemple ).
Tracer la
courbe pH = f(V).
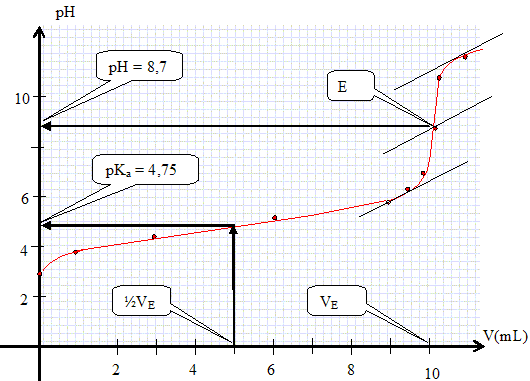
Quelles particularités de la courbe indiquent que l'on a affaire à un dosage d'un acide faible par une base forte ?
La courbe possède deux points d'inflexion ; le pH du point équivalent est supérieur à 7 ; le pH initial est supérieur à -log c0.
Déterminer graphiquement la valeur du pKa de l'acide éthanoïque.
A la demi-équivalence, le pH est égal au pKa du couple acide base. (voir graphe ci-dessus ).
La concentration molaire de la solution d'hydroxyde de sodium est en fait inconnue.
A
partir de quel point de la courbe peut-on déterminer la concentration
de la solution d'acide éthanoïque ? Calculer cette concentration.
A partir du pH initial : CH3COOH aq + H2O(l) = CH3-COO-aq + H3O+
aq.
Ka = 10-4,75 =1,78 10-5 = [CH3-COO-aq][H3O+
aq] / [CH3COOH aq]
La solution est électriquement neutre ( HO- aq négligeable en milieu acide ) : [CH3-COO-aq]=[H3O+
aq] = 10-pH = 10-2,9 =1,26 10-3 mol/L.
Conservation de l'élément carbone : [CH3COOH aq] + [CH3-COO-aq] = c, concentration de l'acide.
[CH3COOH aq] = c-10-pH = c-1,26 10-3 .
1,78 10-5 ( c-1,26 10-3 ) =(1,26 10-3)2 = 1,58 10-6 ; c-1,26 10-3 = 1,58 10-6 /1,78 10-5 =8,876 10-2 ; c =9,0 10-2 mol/L.
Retrouver, par le calcul, la valeur du pH à l'équivalence. ( le volume de la prise d'essai est 10 mL et VE = 10 mL ).
A l'équivalence, on a 20 mL d'une solution d'éthanoate de sodium de concentration c = 0,090 mol/L.
CH3-COO-aq + H2O(l) = CH3COOH aq +HO-aq.
K = [CH3COOH aq] [HO-aq] / [CH3-COO-aq] =[CH3COOH aq] [HO-aq][H3O+
aq] / ([CH3-COO-aq][H3O+
aq]) =10-14 / 10-4,75 =5,62 10-10.
[CH3COOH aq] =[HO-aq] =xf / Vtotal = xf / 0,02 = 50 xf.
[CH3-COO-aq] = c-xf / Vtotal =c-50xf = 0,09-50xf ~ 0,09 ( la réaction de l'ion éthanoate avec l'eau est très limitée
5,62 10-10*0,09 ~ ( 50 xf)2 ; xf =1,42 10-7 ; [HO-aq] =50*1,4224 10-7 =7,112 10-6 mol/L.
Remarque : 50 xf = 50*7,11 10-6 =3,55 10-4 mol /L est bien inférieur à 0,09 mol/L
[H3O+
aq] =10-14 / [HO-aq] =10-14 / 7,112 10-6 =1,406 10-9 mol/L ; pH = 8,8.
|
En mélangeant judicieusement des solutions d'acide éthanoïque et
d'hydroxyde de sodium, on peut réaliser des solutions "tampons" acide
base.
Définir ce type de solution et le pouvoir tampon de telles solutions.
Une solution tampon modère les variations de pH consécutives :
- à l'ajout modéré d'un acide fort ou d'une base forte.
- à une dilution modérée.
Le pouvoir tampon est le nombre
de moles d'acide ou de base forte à ajouter à 1 L de solution tampon pour faire
varier le pH d'une unité. Le pouvoit tampon est maximum à pH = pKa du couple acide base.
Le volume équivalent peut aussi être déterminé par l'utilisation d'un indicateur coloré de pH.
Indiquer le principe de fonctionnement d'un indicateur coloré de pH.
Un
couple acide base dont la forme acide et la forme basique ont des
teintes différentes, peut jouer le role d'indicateur coloré de pH. La
zone de virage s'étend environ de pKa-1 à pKa+1.
A pH inférieur à pKa-1, la teinte acide prédomine ; à pH supérieur à pKa+1, la teinte basique prédomine.
Le dosage des ions fer (II) par les ions permanganate s'opère en milieu acide.
E°(MnO4-aq/Mn2+aq) = 1,51 V ; E°(Cl2g / Cl-aq) = 1,36 V ; E°(NO3-aq/NOaq) =0,96 V ; E°(Fe3+aq/Fe2+aq) =0,77 V.
Exprimer
le potentiel de Nernst à 25 °C pour le couple du permanganate
puis en déduire l'évolution du pouvoir oxydant des ions permanganate en
fonction du pH.
MnO4-aq + 8H+aq + 5e- = Mn2+aq+ 4H2O(l)
E = E°(MnO4-aq/Mn2+aq) +0,06 / 5 log ([MnO4-aq][H+aq]8/[Mn2+aq])
E = 1,51 +0,06*8/5 log [H+aq] +0,06 / 5 log ([MnO4-aq]/[Mn2+aq])
E= 1,51 -0,096pH +0,06 / 5 log ([MnO4-aq]/[Mn2+aq])
E° (pH=0) = 1,51 V ; E° (pH=2) = 1,32 V ; E° (pH=4) = 1,13 V ;
Ecrire l'équation bilan de la réaction de dosage.
MnO4-aq + 8H+aq + 5e- = Mn2+aq+ 4H2O(l) réduction
5 Fe2+aq = 5 Fe3+aq +5e- oxydation
MnO4-aq + 8H+aq + 5 Fe2+aq = Mn2+aq+ 4H2O(l) + 5 Fe3+aq.
Donner les raisons d'un milieu acide pour ce dosage.
Les
ions oxonium sont l'un des réactifs ; le pouvoir oxydant du
permanganate diminue si le pH augmente ; les hydroxydes de fer risquent
de précipiter si le pH augmente.
Pour acidifier le milieu on utilise l'acide sulfurique.
Expliquer pourquoi l'acide nitrique ou l'acide chlorhydrique ne conviennent pas.
L'acide chlorhydrique apporte des ions chlorure qui peuvent être oxydés par l'ion permanganate.
L'acide nitrique apporte des ions nitrate qui peuvent oxyder les ions fer (II).
|
|

