Architecture de
la matière.
Donner la
structure électronique de l'élément azote ( Z=7).
7 électrons; dans l'état fondamental la structure électronique est : 1s2
2s2 2p3.
Indiquer la
structure de Lewis pour les espèces : NH3 ; NH4+
; NO2. ( en précisant les charges formelles)
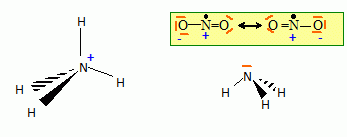
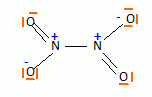
Quelle
particularité électronique présente la molécule NO2 ? En déduire le
schéma de Lewis de N2O4.
La présence d'un électron célibataire sur l'azote fait que
NO2 peut se dimériser.
Rappeler le principe
de la théorie VSEPR et en déduire la géométrie de NH3
et NH4+.
La forme des édifices covalents (molécules ou ions) est
déterminée par la répulsion existant entre les doublets électroniques
de la couche de valence de l'atome central. On note :
A : l'atome central dont il faut compter tous les électrons de
valence
X: atomes ou groupes d'atomes liés à l'atome central par des
liaisons simples ou multiples.
p : nombre de doublets liants ( doublets engagés dans une
liaison)
E : correspond aux doublets non liants ou libres
q : nombre de doublets non engagés
n = p+q : nombre total de doublets du cortège électronique de
l'atome central
notation générale A X p E q
La forme géomètrique dépend du nombre de "volumes
électronique" autour de l'atome central.
- une liaison double, une liaison triple sont comptées pour un
volume électronique, une liaison triple étant plus volumineuse qu'une
liaison double.
La répulsion entre les doublet est différente :
* la répulsion est la plus grande entre 2 doublets non liants.
* la répulsion est un peu moins grande entre un doublet liant
et un doublet non liant
* la répulsion est encore plus faible entre deux doublets
liants.
en conséquence les doublets non liants se placent de telle façon que la
répulsion soit minimale : l'angle d'interaction sera le plus ouvert
possible.
L'ammoniac est du type AX3E, pyramide à base
triangulaire ; l'ion ammonium est du type AX4, tétraèdre.
|
L'ammoniac
en solution aqueuse.
On se place à 298 K.
espèce
|
H3O+
|
HO-aq
|
NH4+aq
|
Cl-aq
|
l (S m2mol-1)
|
3,5
10-2
|
2,0 10-2 |
0,74 10-2 |
0,76 10-2 |
Ecrire l'équation de
la réaction de l'ammoniac avec l'eau.
NH3 aq + H2O(l) = NH4+aq +HO-aq.
La
solution est-elle acide ou basique ?
HO-aq est prépondérant ; la solution est
basique.
|
La mesure de la
conductivité de la solution de concentration c = 8,0 10-4
mol/L donne s = 2,87 10-3
S m-1.
Rappeler
le principe de la mesure de la conductivité. Faut-il étalonner le
conductimètre ?
La sonde de mesure possède une lucarne dont les faces ont une
surface S et sont distantes de d. On mesure la conductance de la
portion de solution comprise entre les deux faces parallèles de la
lucarne.
L'extrémité de la sonde doit être suffisamment immergée. La constante
de cellule permet d'accéder à la conductivité.
Un conductimètre moderne intègre une sonde de température et aucun
étalonnage n'est nécessaire.
Donner
l'expression de la conductivité de la solution.
H3O+aq est minoritaire.
s = lHO-[HO-] + lNH4+[NH4+]
En
déduire la valeur du coefficient de dissociation a de NH3 et le pH de la
solution.
La solution
est électriquement neutre : [HO-] =[NH4+] =s /( lHO- + lNH4+) = 2,87 10-3 /((2
+0,74) 10-2))= 0,1047 mol m-3 = 1,05 10-4
mol /L.
a = [NH4+]éq / c =1,047 10-4
/8,0 10-4 =0,13.
[H3O+] =10-14
/ [HO-] =10-14 /1,05 10-4
=9,5 10-11 ; pH = -log 9,5 10-11
=10.
Calculer
le pKa du couple NH4+aq
/NH3 aq
pH = pKa + log ([NH3]éq / [NH4+]éq avec [NH3]éq = c-[NH4+]éq =8,0 10-4 -1,05 10-4
=6,95 10-4 mol/L.
pKa = 10-log(6,95 / 1,05) = 9,2.
Dosage d'une
solution d'ammoniac par une solution d'acide chlorhydrique de
concentration cA =0,10 mol/L.
On prélève VB
= 10,0 mL de la solution d'ammoniac de concentration cB et
on ajoute 90,0 mL d'eau.
Justifier
l'apport d'une grande quantité d'eau lors d'un suivi conductimétrique.
L'extrémité de la sonde du conductimètre comportant la lucarne de
mesure doit être suffisamment immergée.
Ecrire
l'équation support de la réaction de dosage ( supposée totale).
NH3 aq + H3O+aq =NH4+aq
+H2O(l).
Quelle est l'allure
de la courbe donnant la conductivité de la solution en fonction
du volume d'acide versé ?
Du point de vue de la conductivité :
avant l'équivalence,
dans le becher : l'ammoniac est en excès.
NH4+aq
apparaît et on ajoute des ions chlorure de conductivité molaire ionique
comparable à celle de l'ion ammonium.
la conductivité augmente lentement.
après
l'équivalence, dans le becher : l'acide chlorhydrique est en
excès.
On
ajoute des ions chlorure de conductivité molaire ionique comparable à
celle de l'ion ammonium et des ions H3O+aq de conductivité
molaire ionique bien supérieure à celle des ions ammonium.
La conductivité augmente rapidement.
La courbe est donc constituée de deux segments de droite : l'abscisse
de l'intersection de ces segments donne le volume équivalent.
A.N : VE =
8,9 mL ; calculer
CB.
A l'équivalence : VBcB =VE
cA ; cB =VE
cA /VB = 8,9 *0,10 / 10 = 8,9 10-2 mol/L.
Oxydo-réduction. à 298 K et à ph=0 :
E°(NO3-aq/ NO2(g) = 0,83 V ; E°(NO2(g) /NO2-aq) = 0,85 V.
Déterminer le nombre d'oxydation de l'azote dans NO2, NO2- et NO3-.
NO2 : n.o (N) +2*(-2) = 0 ; n.o (N) = IV.
NO2- : n.o (N) +2*(-2) = -1 ; n.o (N) = III.
NO3- : n.o (N) +3*(-2) = -1 ; n.o (N) = V.
L'acide nitreux HNO2 et l'ion nitrite NO2- forme un couple acido-basique de pKa = 3,3.
Donner le diagramme de prédominance en fonction du pH.
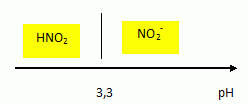
|
Dismutation du dioxyde d'azote.
Ecrire l'équation de la réaction de dismutation du dioxyde d'azote.
En présence d'eau, en milieu acide, on obtient des ions nitrate et des ions nitrite.
(1) NO2(g) + e- = NO2- aq ( réduction )
(2) NO2(g) +3H2O(l) = NO3- aq + 2H3O+aq + e- ( oxydation)
2 NO2(g) +3H2O(l) = NO2- aq + 2H3O+aq +NO3- aq.
Exprimer la constante d'équilibre de cette réaction et la calculer.
K = [NO2- aq] [NO3- aq] [H3O+aq]2 / P2NO2(g).
E1 = E°(NO2(g) /NO2-aq)+0,06 log ( PNO2(g) / [NO2- aq])
E2 =
E°(NO3-aq/ NO2(g) +0,06 log ([NO3- aq] [H3O+aq]2 / PNO2(g))
A l'équilibre E1 =E2 ;
E°(NO2(g) /NO2-aq) - E°(NO3-aq/ NO2(g) = 0,06 log ([NO2- aq] [NO3- aq] [H3O+aq]2 / P2NO2(g))
0,85-0,83 = 0,06 log K ; log K =0,3333 ; K =2,15 ~2,2.
Cette réaction est à l'origine de la formation des pluies acides. Un
atmosphère de pression totale P = 1,0 bar, chargée en dioxyde d'azote,
se trouve en équilibre avec une eau à pH =4,2, l'acidité provenant de
la dismutation du dioxyde d'azote dans l'eau.
Après avoir établi un tableau d'avancement de cette réaction de dismutation,
calculer la pression partielle, en bar, de NO2(g) à l'équilibre.
|
avancement volumique (mol/L)
|
2 NO2(g) |
+3H2O(l) |
= NO2- aq |
+ 2H3O+aq |
+NO3- aq |
initial
|
0
|
a
|
solvant
|
0
|
0
|
0
|
en cours
|
x
|
a-2x
|
en grand
|
x
|
2x
|
x
|
équilibre
|
xéq
|
a-2xéq |
excès
|
xéq |
2xéq |
xéq |
2xéq =10-pH =10-4,2 ; xéq =3,155 10-5 mol/L.
K = [NO2- aq] [NO3- aq] [H3O+aq]2 / P2NO2(g).
K = x2éq(2xéq)2 /P2NO2(g) ; P2NO2(g) =x2éq(2xéq)2 /K
PNO2(g) =xéq(2xéq) /K½ =3,155 10-5 * 10-4,2 / 2,2½ =1,3 10-9 bar.
Fraction molaire en NO2(g) : PNO2(g) /P = 1,3 10-9.
|


