Le glucose de formule brute C6H12O6 est synthétisé par les plantes vertes sous l'action de la lumière, à partir de dioxyde de carbone et d'eau.
Ecrire l'équation de cette réaction.
6CO2 + 6H2O = C6H12O6 +6O2.
Donner le nom usuel attribué à cette transformation.
Synthèse chlorophylienne ou photosynthèse.
Le (+)-glucose a pour structure :
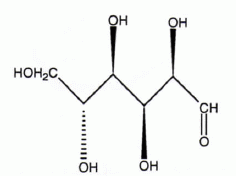
Que signifie le signe (+) ?
Le glucose est dit optiquement actif : il est capable de dévier
le plan d'une lumière polarisée incidente.
On peut classer les substances optiquement actives en deux catégories selon le
signe du pouvoir rotatoire : (+) dextrogyre ou (-) lévogyre.
Déterminer le nombre de stéréoisomères associés à la formule plane du (+)-glucose.
4 carbones asymétriques, donc 24 = 16 isomères possibles.
Indiquer les configurations absolues des atomes de carbones en justifiant.
numéroter de
façon décroissante chacun des quatre substituants selon son numéro
atomique.
On place alors l'atome (ou le
groupement) de numéro le plus élevé derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).

Donner le nom du glucose en nomenclature officielle.
(2R, 3S, 4R, 5R)-2,3,4,5,6-pentahydroxyhexanal.
|
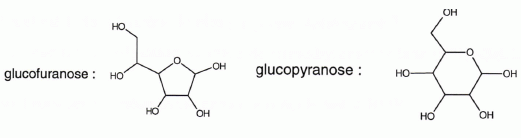
En
présence d'un catalyseur, le glucose peut subir une cyclisation
intramoléculaire conduisant soit à un cycle à 5 atomes, soit un
cycle à 6 atomes.
|
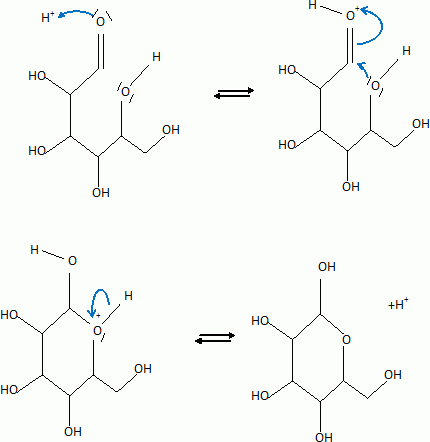
De quel type de catalyseur s'agit-il ? Proposer un mécanisme expliquant la formation de ces deux produits.
La condensation se fait aussi en C1/C4 conduisant à un cycle à 5 éléments.
Par analogie avec les additions nucléophiles sur les composés carbonylés, proposer un nom pour cette réaction.
Condensation cyclique, en milieu acide d'un aldehyde et d'un alcool ( Hémiacétalisation
intramoléculaire).
Le (+)-glucose conduit à 2 stéréoisomères du glucopyranose dits " formes anomères".
Expliquer la formation de ces 2 stéréoisomères. Préciser leur relation de stéréoisomérie.
L'atome de carbone du groupe carbonyle ( aldehyde) est
trigonal plan. L'attaque de H+ se
fait indifféremment d'un côté ou de
l'autre du plan.
Dans la forme cyclique du glucose un nouvel atome de
carbone est créé : sa configuration est R ou S
suivant le côté de l'attaque par
H+.
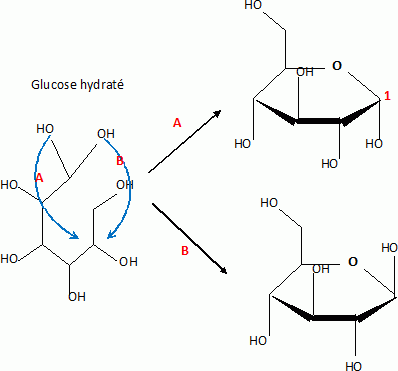
Le carbone 1 est asymétrique : les deux anomères sont énantiomères.
On constate que lorsqu'on met en solution
l'un ou l'autre des anomères, à une concentration de 100 g/L, dans un
tube polarimétrique de longueur 10,0 cm, l'angle du plan de rotation de
polarisation de la lumière q évolue dans le temps puis se stabilise, après quelques heures, à la valeur q
= 5,25 °. On supposera que chaque anomère est en équilibre avec la
forme ouverte, présente en proportion négligeable. On donne les
pouvoirs rotatoires spécifiques suivants :
a(+)-glucopyranose : [q]a = 112,1° g-1 mL dm-1 ; b(+)-glucopyranose : [q]b = 19,1° g-1 mL dm-1.
Ecrire la loi de Biot, en explicitant tous les termes intervenant.
La loi de Biot traduit la
proportionnalité entre le pouvoir rotatoire d'un
milieu et les concentrations en produits optiquement actifs
(dextrogyres ou lévogyres) :
a
= [a]l,
T.C.L
a
(°) angle de rotation du plan de vibration des ondes
lumineuses ; [a]
: pouvoir rotatoire spécifique ( ° m2
kg-1 ); C: concentration ( kg
m-3 ) ; L: longueur (m) de
cuve.
Donner le principe de la mesure d'un pouvoir rotatoire spécifique.
Dissoudre 10 g de de substance otpiquement active dans 100 mL d'eau distillée.
Rincer le tube polarimétrique et régler le zéro avec de l'eau distillée.
Effectuer la lecture en ayant préalablement rincé le tube avec la solution à
doser.
Déterminer les proportions de ces deux anomères en l'équilibre.
[q]a = 1,121° m2
kg-1 ; b(+)-glucopyranose : [q]b = 0,191° m2
kg-1.
q = [q]a.Ca.L + [q]b.Cb.L.
5,25 =1,121 Ca. 0,100 + 0,191 Cb. 0,100 ; 52,5 =1,121 Ca + 0,191 Cb (1)
Conservation de l'élément carbone : 100 g/L = 0,1 kg/L = 100 kg m-3.
100 = Ca+Cb ; Ca= 100- Cb ; repport dans (1) :
52,5 =112,1-1,121 Cb + 0,191 Cb d'où Cb =64,1 kg m-3 ( 64,1 % ) ; Ca (35,9 %).
Un des deux stéréoisomères a pour représentation de Haworth :
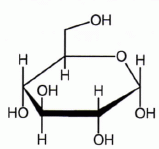
Représenter la conformation chaise la plus stable de cet isomère. Procéder de même pour l'autre isomère.
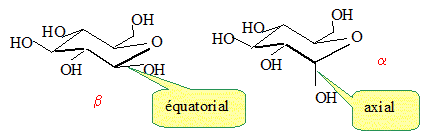
L'anomère le plus stable est
celui où tous les groupes sont en position
équatoriale.
Une
autre façon d'étudier les proportions de ces deux anomères est de
réaliser une substitution de tous les hydrogènes labiles des fonctions
alcools par des groupes triméthylsilyle( -SiMe3).
Ainsi, les dérivés du glucose peuvent être analysés en CPG car la
protection des sites hydrophiles diminue le temps de rétention sur la
colonne et la température d'analyse. La CPG permet de réaliser la
séparation des dérivéssilylés des deux isomères et d'en donner par
intégration des pics du chromatogramme, les proportions respectives.
Quel est l'état physique le plus fréquent de la phase stationnaire ?
Grains de silice sur lesquels repose un film liquide.
La réaction de silylation se fait en présence de triméthylchlorosilane (CH3)3SiCl dans la pyridine.
Proposer un mécanisme général avec une molécule notée ROH.
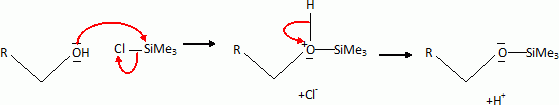
La pyridine joue le rôle d'activant ; de plus, c'est une base qui piège l'acide chlorhydrique formé au cours de la réaction.
La déprotection de l'alcool R-OH est réalisée en milieu acide.
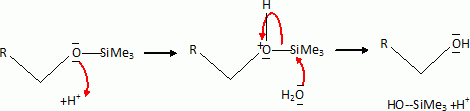
|
Le (+)-glucose peut réagir avec Na+, BH4- dans un solvant mixte éthanol eau.
Nommer le composé Na+, BH4-.
Borohydrure de sodium.
Donner le schéma de Lewis de l'ion BH4-.
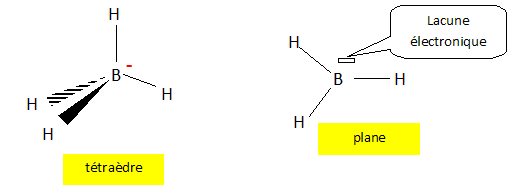
Proposer un mécanisme pour la réaction et donner le produit obtenu.
NaBH4 est un donneur d'hydrure. Le mécanisme est identique dans le cas d'un aldehyde. On obtient un alcool.
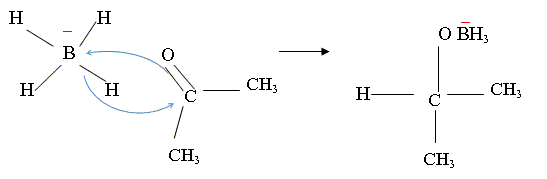
Puis (CH3)2CH
OBH3- +
(CH3)2CO =
[(CH3)2CH
O]2BH2-.
[(CH3)2CH
O]2BH2- +
(CH3)2CO =
[(CH3)2CH
O]3BH-.
[(CH3)2CH
O]3BH- +
(CH3)2CO =
[(CH3)2CH
O]4B-.
[(CH3)2CH
O]4B- +4H2O =4
(CH3)2CH OH
+B(OH)3 + HO-.
On fait réagir une mole de glucose avec 0,4 mole de NaBH4 pour avoir une réaction totale. Justifier.
NaBH4 peut fournir 4 ions hydrure, donc réagir théoriquement avec 4 fonctions aldehyde ( voir ci-dessus).
Pourquoi n'utilise t-on pas LiAlH4 ?
NaBH4 est un réducteur doux, beaucoup plus sélectif.
Une des réactions caractéristiques du (+)-glucose est la suivante :
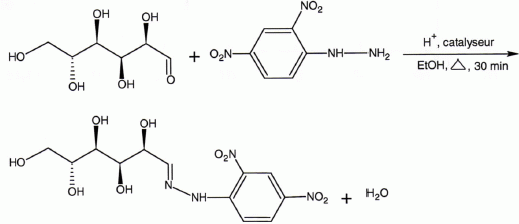
Nommer ce test, préciser quelle fonction il caractérise ; proposer un mécanisme.
En présence d'u groupe carbonyle d'un aldehyde ou d'une cétone, la 2,4 -DNPH donne un solide jaune orangé.
L'aldehyde est noté Ar :
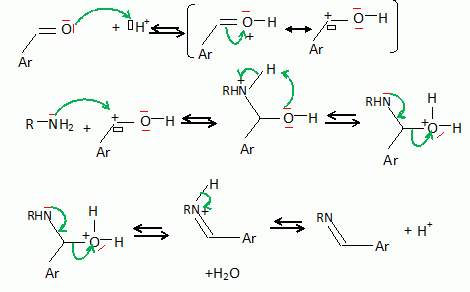
|
|












