Les tensioactifs.
Un
tensioactif est un composé amphiphile. Il existe quatre grande classes
de tensioactifs : les anioniques, les cationiques, les amphotères et
les non-ioniques.
Souvent on les schématise ainsi :
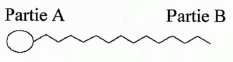
Quel est
le rôle d'un tensioactif ? Préciser ses propriétés essentielles.
Un tensioactif modifie la tension superficielle entre deux
surfaces. Il permet de solubiliser deux phases non miscibles.
Ce sont des agents émulsifiants ou des agents stabilisants.
Définir le terme
amphiphile.
Les tensioactifs possèdent deux parties de polarité différente, l'une
est liphophile et apolaire ( qui fixe les matières grasses ), l'autre
hydrophile et polaire ( qui est miscible à l'eau).
Donner
un exemple ( nom et formule ) d'un tensioactif anionique, cationique et
amphotère.
anionique : R-SO3- Na+,
alkylbenzènesulfonate
cationique R-N(CH3)3+ Cl-,
chlorure de tétralkylammonium
amphotère -OOC-CH2-N+(CH3)3,
acides aminés substitués.
Préciser la
propriété de la partie A d'un tensioactif non ionique. Expliquer
comment cette partie se lie avec le solvant.
La partie A possède
des groupes hydrophiles non ionisés ( fonction alcool par exemple). Il
se forme ainsi des liaisons hydrogène entre les molécules d'eau et les
fonctions de la partie hydrophile A.
Mécanisme d'enlèvement d'une tache
de graisse.
Expliquer
( schémas à l'appui ) la façon dont un tensioactif anionique détache
une salissure de graisse sur un tissu.
|
Lors de l'action d'un agent
tensio-actif il y a formation de micelles.
Le schéma
ci-dessous
représente une micelle de type " huile dans l'eau".
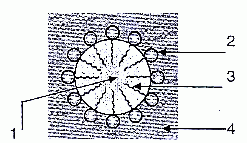
1 : huile
2 : partie hydrophile du tensioactif
3 : partie hydrophobe du tensio-actif
4 : eau.
Lorsqu'on
frotte le tissu, la graisse se décolle de celui-ci et se retrouve entourée de molécules de
tensioactif, enfermée dans une micelle qui ne se colle pas au tissu
puisque la surface de la micelle est hydrophile".
|
Les
eaux dures sont néfastes à l'action d'un tensioactif anionique,
notamment sur les fibres de coton ( qui présentent de nombreux sites
négatifs ).
Expliquer pourquoi ? Comment résoudre ce
problème ?
Une eau dure contient des ions calcium et
magnésium. Ces ions donnent avec les molécules tensioactives présentes
dans le savon des composés insolubles.
Il y a donc moins de savon disponible en solution : le pouvoir
détergent d'un savon dans une eau dure est plus faible que dans une eau
douce.
On introduit des additifs qui masquent les ions métalliques aux
tensioactifs.
Etude
d'un agent de blanchiment.
Les
taches colorées de thé, chocolat, curry... ne sont pas enlevées par les
tensioactifs mais sont décolorées par des agents de blanchiment tels
que le perborate de sodium ou le percarbonate de sodium.
L'anion perborate a pour formule semi-développée :
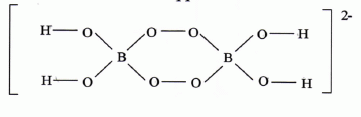
Déterminer
le nombre d'oxydation des différents éléments mis en jeu.
Le nombre d'oxydation de l'élément hydrogène vaut +1.
Le nombre d'oxydation de l'élément oxygène dans les groupes OH est égal à -2.
Le nombre d'oxydation de l'élément oxygène dans les groupes peroxyde O-O est égal à -1.
Pour l'ensemble de l'ion, le nombre d'oxydation est égal à la charge soit -2 :
4 n.o(H) + 4n.o(O) groupe OH + 4 n.o(O) peroxyde + 2 n.o(B) = -2
4 +4*(-2) +4*(-1) + 2n.o(B) = -2 ; -8 + 2n.o(B) = -2 ; n.o(B) = +3.
Lorsqu'il se dissout dans l'eau, le perborate de sodium Na2B2O8H4, 6H2O se décompose à chaud, à des températures supérieures à 60°C, pour donner des ions tétrahydroxoborate B(OH)4- et de l'eau oxygénée.
Ecrire l'équation de cette décomposition. Justifier s'il s'agit d'une réaction d'oxydoréduction.
Na2B2O8H4, 6H2O = 2B(OH)4- + 2H2O2 + 2Na++ 2H2O.
Dans B(OH)4- : n.o(B) = 3 ; n.o(H) =1 ; n.o(O) = -2
Dans H2O2 : n.o(H) =1 ; n.o(O) = -1 ;
Dans H2O : n.o(H) =1 ; n.o(O) = -2 ;
Dans Na2B2O8H4, 6H2O :
10 éléments oxygène ont pour nombre d'oxydation -2 et 4 élément oxygène ont pour nombre d'oxydation -1.
dans les produits : 2B(OH)4- + 2H2O2 + 2Na++ 2H2O.
10 éléments oxygène ont pour nombre d'oxydation -2 et 4 élément oxygène ont pour nombre d'oxydation -1.
Aucun nombre d'oxydation ne change, ce n'est pas une réaction d'oxydoréduction.
Préciser sous quelle forme se trouve majoritairement l'eau oxygénée, sachant que l'eau de lessive est fortement basique.
pKa ( H2O2 / H2O-) = 11,6 ; à pH supérieur à pKa, la forme base du couple acide base prédomine, c'est à dire H2O-.
Pour
permettre de faire la lessive à température plus basse, on utilise des
activateurs. C'est le cas du tétraacéthyléthylènediammine, ou TAED. En
réagissant avec l'eau oxygénée, il conduit à la formation d'acide
peracétique.
Donner
les formules semi-développées du TAED et de l'acide peracétique.
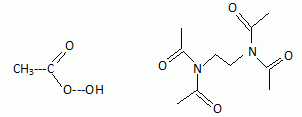
|
La
curcumine est un colorant alimentaire jaune de code E100 issu du
curcuma. Il est notamment utilisé dans les glaces, les yaourth, le
curry. Sa structure est précisée ci-dessous :
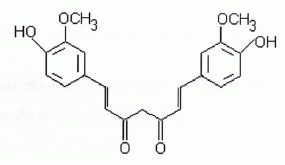
Expliquer
pourquoi cette molécule est colorée. Comment qualifie t-on les groupes
hydroxyle lorsqu'on s'intéresse à la couleur de la curcumine ?
Le déplacement bathochrome est une modification de la position de la
bande spectrale d’une molécule vers les plus
grandes longueurs d'onde.
Quand la taille du système conjugué croit, on observe une augmentation de la
longueur d'onde du maximum d'absorption. Lorsque le nombre de double liaisons conjuguées est très élevé, la
molécule absorbe la lumière dans la partie visible du spectre.
De
plus la déprotonation et le passage à l'ion phénolate provoquent un
effet bathochrome, le nombre de liaisons conjuguées est encore plus
élevé. Les groupes hydroxyles, groupes auxochromes, jouent un rôle dans la couleur.
L'eau oxygénée en milieu basique oxyde certaines doubles liaisons carbone carbone.
Pourquoi les lessives contenant des agents de blanchiments peuvent-elles décolorer les taches de curcumine ?
Un agent de blanchiment libère de l'eau oxygénée ; le milieu étant basique, l'eau oxygénée oxyde certaines doubles liaisons carbone carbone. La taille du système conjugué diminue et en conséquence, la
molécule n' absorbe plus la lumière dans la partie visible du spectre.
|




