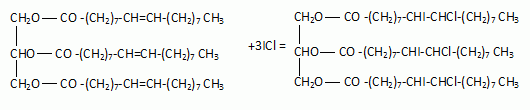Les
lipides constituent une famille biochimique du vivant importante. Ils
sont formés à partir d'acides gras, composés essentiellement de
carbone, d'oxygène et d'hydrogène.
Parmi les lipides, on trouve les huiles et les graisses que l'on
appelle corps gras.
Définitions,
structure, propriétés.
Donner la
position dans le tableau périodique des trois éléments H, O et C.
Etablir la configuration électronique des atomes dans leur état
fondamental.
H : 1ère colonne, 1ère ligne ; 1s1.
C : seconde ligne ou période, colonne ou groupe : 14 ; 1s2 2s2 2p2 .
O :
seconde ligne ou période, colonne ou groupe : 16 ; 1s2 2s2 2p4 .
Définir
lipide, acide gras, acide gras saturé, acide gras insaturé.
Les lipides constituent la matière grasse des êtres
vivants ; par exemple, les acides gras et leurs dérivés, leurs esters.
Une acide gras est un un acide carboxylique à chaine aliphatique :
- un acide gras saturé est un acide gras dans lequel tous les atomes de
carbone sont saturés en hydrogène.
- un acide gras insaturé est un acide gras qui possède une ou plusieurs
doubles liaisons carbone-carbone.
Etablir la formule
brute d'un acide gras saturé puis celle d'un acide gras mono-insaturé
comportant n carbones.
Acide carboxylique saturé, à chaîne aliphatique : Cn H2n
O2.
Acide carboxylique mono-insaturé ( une seule double liaison entre deux
carbones ), à chaîne aliphatique : Cn H2n-2 O2.
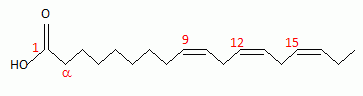
Représenter
la formule semi-développée de l'acide a-linolénique (18 : 3
cis, cis, cis, n-3, n-6, n-9 ).
18 atomes de carbone, trois double liaisons ( leur géométrie est cis )
situées entre le carbone n°2 et n°3, entre le carbone n°5 et n°6, entre
le carbone n°8 et n°9 ; le carbone "n" est le groupe méthyle situé en
bout de chaîne.
acide 9Z, 12Z, 15Z octadécatriènoïque.
Calculer
le nombre de stéréoisomères de cet acide a priori possibles.
3 doubles liaisons carbone carbone : 23 = 8 stéréoisomères.
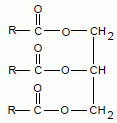
Les
triglycérides.
Préciser
l'origine de l'appellation triglycérides.
Ce sont des triesters du glycérol.
|
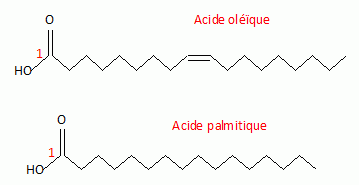
L'oléine
est le triglycéride issu de l'acide oléique ( 18 : 1 cis, n-9) et la
palmitine le triglycéride issu de l'acide palmitique ( 16 : 0). Ecrire les formules
topologiques de ces acides.
|
Nommer les
paramètres qui ont un rôle sur la température de fusion des
acides gras.
acide
gras
|
température
de fusion ( °C)
|
6 : 0
|
-3
|
8 : 0
|
16
|
12 : 0
|
44
|
18 : 0
|
69
|
20 : 0
|
75
|
18 : 1
|
13
|
18 : 2
|
-5
|
18 : 3
|
-11
|
24 : 1
|
43
|
Lorsque le nombre d'atome de carbone d'un acide gras ( le
nombre de double liaison carbone carbone restant constant) augmente, la
température de fusion croït.
Lorsque le nombre de double liaison carbone carbone augmente ( à nombre
de carbone constant ), la température de fusion décroït.
Evaluer
l'ordre de grandeur de la température de fusion des acides
suivants : acide béhénique 22 : 0 et acide érucique 22 : 1.
Acide béhénique : la température de fusion est de l'ordre de 80 °C.
( 18 : 0 , Tf = 69°C et 20 : 0 , Tf = 75°C )
Acide érucique : la température de fusion est de l'ordre de 30 °C.
( 18 : 1 , Tf = 13°C et 24 : 1 , Tf = 43°C ).
Décrire en moins de
4 ligne deux rôles majeurs des lipides.
Les lipides apportent à un organisme vivant une quantité d'énergie
suffisante à son fonctionnement.
Les lipides transportent dans le sang les protéines et les hormones
essentielles au bon fonctionnement de l'organisme.
Citer
deux familles biochimiques importantes du vivant autres que les lipides.
Les glucides, les protéines.
Caractéristiques
d'une huile.
Une huile contient des acides gras en quantité variable.
Proposer
une explication à cette présence d'acide gras non estérifiés.
Au cours du temps et au contact de l'air humide un corps gras
s'hydrolyse lentement pour donner du glycérol des acides carboxyliques.
L'huile considérée par la suite est un mélange de deux glycérides,
l'oléine C57H104O6 et la palmitine C51H98O6.
Il s'agit de déterminer la composition massique de cette huile. On
suppose que cette huile contient des acides gras en quantité
suffisamment faible pour pouvoir être négligés.
L'indice de saponification est donné par la masse de potasse ( exprimée
en mg ) qui permet de saponifier les esters présents et de neutraliser
les acides également présents dans une masse de 1,0 g du corps
gras. Pour déterminer cet indice, on introduit :
- dans un ballon, noté I, des volumes V = 20 mL d'éthanol à 95 % et V'
= 20,0 mL de solution alcoolique de potasse.
- dans un ballon, noté II, une masse m = 0,50 g de l'huile étudiée et
des volumes V = 20 mL d'éthanol à 95 % et V' = 20,0 mL de solution
alcoolique de potasse.
On chauffe à reflux pendant deux heures les deux ballons.
Après avoir laisser refroidir les montages, on titre l'excès d'ion
hydroxyde par une solution d'acide chlorhydrique de concentration CA
= 0,198 mol/L en présence de phénolphtaléine.
Pour observer le changement de teinte de l'indicateur coloré, il faut
verser V1 = 22,3 mL de la solution d'acide chlorhydrique
dans le ballon I et V2 = 13,5 mL dans le ballon
II.
Avec
quels instruments a t-on mesuré les volumes V et V' ?
V n'est pas très précis : éprouvette graduée de 50 mL.
V' est précis : pipette jaugée de 20,0 mL.
Justifier
le fait que l'on utilise de l'éthanol et une solution alcoolique
de potasse.
Une des difficultés rencontrées lors de la saponification provient du
fait que l'huile n'est pas miscible à l'eau : on est en présence d'une
phase aqueuse contenant l'ion hydroxyde et d'une phase organique
contenant le triglycéride. On cherche donc à « transférer » l'ion
hydroxyde en phase organique.
Dessiner
le montage à reflux et en nommer les différentes parties.
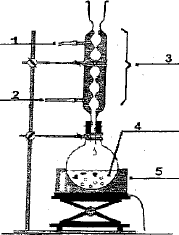
(1) sortie de l'eau ; (2) entrée de l'eau ; (3)
réfrigérant à eau ; (4) ballon ; (5) chauffe ballon
Ecrire
l'équation des réactions de saponification de l'oléine, notée (1) et de
la palmitine, notée (2), en utilisant les formules semi-développées.
ROCH2-
CH(OR)- CH2OR + 3 (K+ + HO- ) = 3 (R-O-
+ K+ ) + HOCH2- CH(OH)- CH2OH
avec R : CH3-(CH2)7-CH=CH-(CH2)7 -CO- pour l'oléine et R : CH3-(CH2)14
-CO- pour la palmitine.
Ecrire
l'équation de la ( des) réaction(s) envisageable(s) lors de l'addition
de l'acide. Justifier le choix de l'indicateur coloré.
Ballon I : HO-aq + H3O+aq = 2H2O(l).
Ballon II : HO-aq + H3O+aq = 2H2O(l) réaction
prépondérante de constante 1014.
R-O-
aq + H3O+aq =
ROH +H2O(l).
La zone de virage de la phénolphtaléine est comprise entre pH=8,2 et pH
= 10.
A l'équivalence du dosage des ions HO-aq en
excès par H3O+aq,
la solution du ballon II contient des bases faibles ( ions oléate et
palmitate ) : le pH est donc légèrement supérieur à 7 ( de l'ordre de 8
).
La
phénolphatéléine passe du rose à l'incolore dès que tous les ions
HO-aq en excès sont dosés ; par
contre les bases ( oléate et
palmitate ) ne sont pas encore dosées.
Déterminer
la concentration de la solution de potasse utilisée.
Ballon I : à l'équivalence, CA V1
=CB V' ; CB = CA V1 / V'
=0,198 *22,3 / 20,0 = 0,22077 ~0,221
mol/L.
Pourquoi
faut-il étalonner la solution de potasse ?
Une solution de potasse ou de soude dissout le dioxyde de carbone de
l'air : une réaction acide base se produit entre les ions hydroxyde et
le CO2 dissout ; la solution se carbonate. Il faut
donc étalonner la solution de potasse : c'est le rôle du ballon I.
En
déduire l'indice de saponification de l'huile.
Ballon II : à l'équivalence, CA
V2 =0,198 * 13,5 10-3 = 2,673 10-3
mol de potasse en excès.
Quantité de matière initiale de potasse : CB V' = CA V1
=0,198 *22,3 10-3 = 4,4154 10-3 mol.
Quantité de matière de potasse utilisée pour la saponification : n
= 4,4154 10-3 - 2,673 10-3 =1,7424 10-3
mol.
Masse de potasse : n M = 1,7424 10-3 *56,1 =9,774 10-2
g pour une masse m = 0,50 g d'huile.
soit 195 mg
de potasse pour 1,0 g d'huile.
L'indice
d'iode est donné par la masse de diiode ( exprimée en g ) qui
pourrait se fixer, par addition sur 100 g de corps gras. En fait on
utilise le réactif de Wijs constitué par une solution de chlorure
d'iode ICl dans l'acide acétique. Pour déterminer l'indice d'iode on
introduit :
- dans un erlenmeyer, noté I, des volumes V = 30 mL de trichlorométhane
et V' = 25,0 mL de réactif de Wijs.
- dans un erlenmeyer, noté II, une masse m = 0,50 g de l'huile étudiée,
des volumes V = 30 mL de trichlorométhane et V' = 25,0 mL de réactif de
Wijs.
On place les deux erlenmeyer à l'obscurité pendant deux heures. On
ajoute ensuite dans chacun d'entre eux, 4 g d'iodure de potassium et
140 mL d'eau distillée et on agite.
On titre ensuite les solutions obtenues par une solution de thiosulfate
de sodium de concentration C = 0,200 mol/L.
Pour l'erlenmeyer I, le volume équivalent vaut VE1 = 23,2 mL
; pour l'erlenmeyer II, le volume équivalent vaut VE2 = 10,8
mL.
Ecrire
l'équation de la réaction qui a lieu entre l'oléine et le chlorure
d'iode.
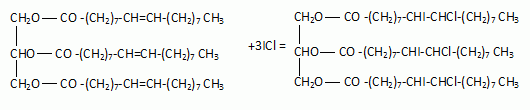
On utilise le
chlorure d'iode à la place du diiode : le diiode se fixe très
lentement sur les doubles liaisons, le chlorure d'iode (réactif de
Wijs) réagit plus facilement.
La palmitine ne
possédant pas de liaison double carbone carbone ne réagit pas avec le
chlorure d'iode.
ICl est introduit en excès dans le
milieu
réactionnel. Le chlorure d’iode qui n’a pas réagi est ensuite
détruit par ajout d’une solution aqueuse d’iodure de potassium :
par
réaction entre l’ion iodure et le chlorure d’iode il se forme des
molécules de
diiode et des ions chlorure.
ICl (excès) + I-aq =I2 aq + Cl-aq.
(b)
La masse de iodure de
potassium ne doit pas être très précise, il suffit que KI soit en
excès par rapport à ICl restant.
Ecrire la
réaction de titrage.
couples oxydant / réducteur : S4O62-
aq/ S2O32- aq; I2 aq/ I-aq.
I2 aq+2e- = 2 I-aq réduction
du diiode
2S2O32- aq = S4O62-
aq +2e- oxydation de l'ion thiosulfate
2S2O32- aq +I2 aq = S4O62-
aq+2 I-aq. (c)
En présence de diiode,
l'empois d'amidon prend une teinte bleu-foncé caractéristique : on peut
ainsi repérer la fin du titrage avec précision.
Déterminer
la quantité de diiode contenue dans chaque erlenmeyer après ajout de
l'iodure de potassium et avant le titrage.
D'après les coefficients stoechiomètriques de l'équation (c) les quantités de
matière (mol) d'ion thiosulfate est égale à deux fois la quantité de
matière de diiode.
n(S2O32-) = 2 n(I2) avec n(S2O32-)
= CVE1 = 0,200 *
23,2 10-3 = 4,64 10-3 mol
d'où n(I2)I = 2,32 10-3 mol dans
l'erlenmeyer I.
n(S2O32-)
= CVE2 = 0,200 * 10,8
10-3 = 2,16 10-3 mol
d'où n(I2)II = 1,08 10-3 mol dans
l'erlenmeyer II.
Calculer
la quantité de chlorure d'iode qui a été fixée par l'huile étudiée.
n ICl = n(I2)I -n(I2)II
=(2,32-1,08) 10-3 = 1,24 10-3 mol.
En
déduire l'indice d'iode de l'huile.
n ICl = n(I2) ; masse de diiode : n(I2)
M = 1,24 10-3 *253,8 =0,31471 g de diiode pour 0,50 g
d'huile.
soit 0,31471 *100/0,5 = 62,94 g ~ 63 g de diiode pour 100
g d'huile.
|
Soient nol et
npal les quantités respectives d'oléine et de palmitine
contenues dans 1,00 g de l'huile considérée.
Déduire
de l'indice de saponification la quantité de triesters présents dans
1,00 g de l'huile considérée.
Quantité de matière de potasse utilisée
pour la saponification : nKOH =1,7424 10-3
mol pour 0,50 g d'huile.
Soit pour 1,00 g d'huile : 2nKOH =3,4848 10-3
mol.
ntriester = 2nKOH / 3 = 3,4848 10-3
/ 3 =1,1616 10-3 mol ~ 1,16 10-3
mol.
A
partir de l'indice d'iode et du résultat précédent, déterminer les
quantités respectives ( en mol et en g ) d'oléine et de palmitine
présentes dans 1,00 g d'huile.
Seule l'oléine est
insatuée ( trois insaturations ) : nol = n(I2)
/ 3 = 1,24 10-3 / 3 =4,1333 10-4 mol pour 0,5
g d'huile.
nol =2 *4,1333 10-4 = 8,2666 10-4 mol ~ 8,27 10-4 mol pour 1,00 g d'huile.
npal =1,1616 10-3 -8,2666 10-4 =3,35 10-4
mol.
Et en masse : mol =nol Mol =8,2666 10-4 *884 =0,73 g.
mpal =npal Mpal =3,35 10-4 *806 =0,27 g.
Composition massique : 73 % oléine et 27 % palmitine.
Etude
cinétique d'une saponification.
A t=0 on réalise un mélange équimolaire d'éthanoate d'éthyle et
d'hydroxyde de sodium. la température est maintenue à 25 °C. On mesure
au cours du temps la concentration en hydroxyde de sodium.
t(s)
|
0
|
60
|
120
|
180
|
240
|
300
|
360
|
[HO-]
mmol L-1
|
20,0
|
16,2
|
13,5
|
11,8
|
10,3
|
9,2
|
8,3
|
Ecrire l'équation de
la réaction.
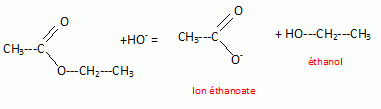
Montrer
que les résultats expérimentaux sont en accord avec un ordre global 2
pour la réaction.
t(s)
|
0
|
60
|
120
|
180
|
240
|
300
|
360
|
1/[HO-]
L mol-1
|
50
|
61,7
|
74,1
|
84,7
|
97,1
|
108,1
|
120,5
|
| 1/[HO-]-
1/[HO-]0 |
0
|
11,7
|
24,1
|
34,7
|
47,1
|
58,1
|
70,5
|
k
= [ 1/[HO-]- 1/[HO-]0 ] / t
|
xxx
|
0,195
|
0,20
|
0,193
|
0,197
|
0,194
|
0,196
|
La constante de vitesse
k étant constante, l'hypothèse d'un ordre global de 2 est vérifiée.
En
déduire la valeur de la constante de vitesse k.
k = 0,196 L mol-1 s-1.
|
|