le
cuivre dans le vin peut provenir d'un traitement de la vigne à la
bouillie bordelaise ou encore du contact de matériaux à base de cuivre
comme les laitons que l'on trouve encore notamment dans les pompes les
plus anciennes.
Les alliages de cuivre.
On
estime que plus de 70% de la production de cuivre est utilisée à l'état
de cuivre pur pour la fabrication de fils électriques, de laminés, de
tubes. Le reste sert à élaborer de très nombreux alliages de cuivre
dont l'importance est considérable. Les plus fabriqués sont les laitons
dénomés cuivre jaune ; viennent ensuite les bronzes, les
cuproaluminiums, les cupronickels, etc.
Quels sont les métaux constituant le laiton ?
Le laiton est un alliage de cuivre et de zinc. Il contient souvent aussi le plomb, l'étain, le nickel, le chrome et le magnésium.
Les
alliages de cuivre et de nickel sont couramment utilisés pour les
transports de matériaux corrosifs, la construction mécanique et
la fabrication de monnaies.
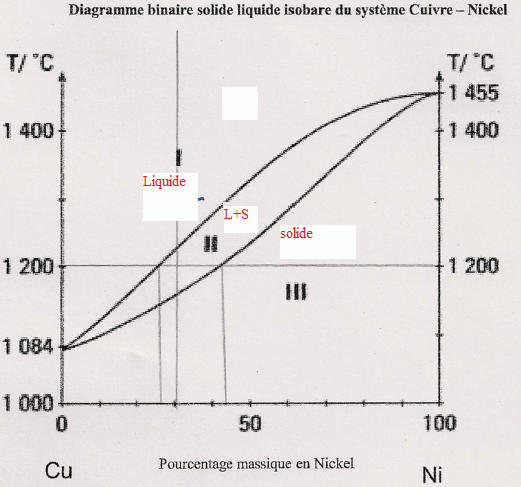
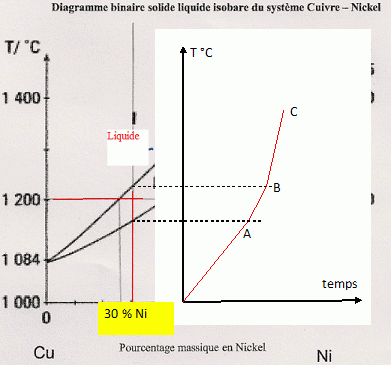
Représenter
l'allure de la variation de température en fonction du temps lors du
réchauffement très lent et régulier d'un alliage de composition 30% en
masse de nickel à partir de 1000°C.
|
Un seul facteur physique, la pression étant constante.
de 1000°C jusqu'en A : une seule phase de solides miscibles ; deux constituants indépendants ; v = 2+1-1 = 2.
La température du solide augmente.
A à B : deux phases, liquide + solide ; v = 2+1-2 = 1.
B à C : une seule phase liquide ; v = 2+1-1 = 2
A chaque rupture de pente la variance change de une unité.
|
2000 g d'un alliage de composition massique 30 % en masse de nickel est porté à 1200 °C.
Préciser la composition en masse de chacune des phases.

Règle des moments chimiques : mL ML = mS MS avec mS : masse de la phase solide et mL masse de la phase liquide.
0,04 mL= 0,12 mS ; mL= 3 mS ; mL+ mS =2000 ; mS =500 g et mL= 1500 g.
La composition du liquide est donnée par l'abscisse du point L, point figurant sur le liquidus : 26% en Ni.
La composition du solide est donnée par le point S, point figurant sur le solidus : 42 % Ni.
Dosage par absorption atomique du cuivre II dans le vin.
Les
moûts de raisin renferment toujours des doses importantes d'ions
cuivriques ; quelques dixièmes de mg / L sont issus de la vigne, mais
la majeure partie vient des différents traitements subis. Lors de la
fermentation, ils sont éliminés avec les levures et les lies. Ainsi le
vin nouveau n'en contient que 0,2 à 0,3 mg/L ; mais après quelques mois
de conservation les vins peuvent en contenir plus, à la suite du
contact avec le matériel en cuivre, en laiton ou en bronze. dans
les vins blancs ou rosés maintenus à l'abri de l'air, les
ions cuivriques précipitent à l'état de sulfures qui troublent le vin
si la dose de cuivre approche de 1 mg/L. De plus il favorise
l'apparition de la casse blanche ( casse ferrique ) en jouant le rôle
de catalyseur. Le cuivre est éliminé des vins par traitement au
ferrocyanure de potassium ou par le sulfure de sodium qui le
précipite à l'état de sulfure. Il est recommandé que la teneur en
cuivre du vin ne dépasse pas 0,8 mg / L.
La méthode normalisée de dosage du cuivre dans le vin utilise la technique d'absorption atomique.
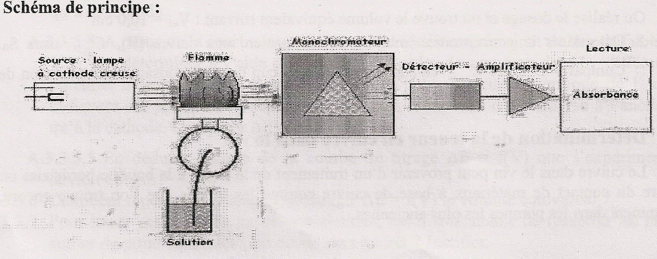
L'élément
étudié est sous forme d'ion en solution aqueuse. La solution est
nébulisée dans une flamme. Les ions y sont alors atomisés. La flamme
utilisée est obtenue par un mélange air-acéthylène. Quand la solution
passe dans la flamme, une partie des atomes est excitée, une autre
restant à l'état fondamental. L'étude porte sur la population restant à
l'état fondamental. On mesure l'absorption de l'élément quand il est
éclairé par une source lumineuse de longueur d'onde spécifique
caractéristique de l'élément étudié, choisie de façon à ce qu'il puisse
absorber la radiation émise par la source.
L'absorbance A de la solution suit une loi de type Beer-Lambert ( A = KCCu où A est l'absorbance, CCu
la concentration totale en élément cuivre, K un coefficient propre à
chaque élément pour la longueur d'onde choisie ). Cette loi n'est
valable que pour les concentrations faibles, typiquement inférieures à
3 ppm.
A quelle condition une radiation lumineuse peut-elle e^tre absorbée par un atome ?
L'énergie du photon doit être égale à la différence d'énergie entre deux niveaux d'énergie quantifiée de l'atome.
Définir l'absorbance de la solution.
Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) ( A est
l'absorbance
ou densité
optique)
Que sinifie ppm ?
partie par million.
Evaluation de la température de flamme.
On s'intéresse à la zone de combustion primaire de la flamme, là où le
mélange air acéthylène s'effectue en proportions stoechiométriques. On
considère que l'air est constitué de 80 % de diazote et de
20 % de dioxygène. C'est le dard de la flamme qui correspond à la zone
blanche de la flamme. Les gaz entrent à 298 K dans la flamme sous
une pression de 1,0 bar et on admet que le système gazeux évolue de
manière adiabatique. L'équation de la réaction de combustion associée à
cette transformation est :
C2H2(g) + 2,5 O2(g) = 2 CO2(g) + H2O(g).
Calculer l'enthalpie standard de combustion de l'acéthylène.
DfH°(C2H2(g))=226 kJ/mol ; DfH°(CO2(g))= -393 kJ/mol ; DfH°(H2O)= -242 kJ/mol ;
DrH° =2 DfH°(CO2(g)) +DfH°(H2O) -DfH°(C2H2(g)) =-2*393-242-226 = -1254 kJ/mol.
Calculer la valeur de la température des gaz après combustion complète sous une pression de 1,0 bar.
avant combustion : C2H2(g) : n0 ;
O2(g): 2,5 n0 ;
N2(g): 10 n0 ;
après
combustion : H2O(g) : n0 ; N2(g): 10 n0 ; CO2(g): 2
n0.
L'énergie
dégagée par la combustion chauffe les
produits formés :
n0
DrH°
+ [2n0CP CO2 + 10 n0CP N2 +
n0CP H2O ]
(Tf-T0) =0
Tf-T0
= -DrH°
/ [2CP CO2 + 10 CP N2
+ CP H2O
]
Tf =
T0 - DrH°
/ [2CP CO2 + 10 CP N2
+ CP H2O
].
A.N : CP CO2 = 36,9 ; CP H2O = 36,2 ; CP N2 =29,3 J mol-1 K-1.
Tf = 298 + 1,254 106
/ [2*36,9 + 293+ 36,2] = 3,4 103 K.
Pourquoi peut-on faire l'hypothèse d'une transformation adiabatique ?
La combustion dans l’air est suffisamment rapide pour être
adiabatique.
|
Soit une solution étalon S d'ion cuivre (II) à la concentration de 10,00 mg/L.
La méthode préconisée dans le vin est celle des ajouts dosés. Des
quantités connues de la solution S de cuivre (II) sont ajoutées à des
prélevements identiques de l'échantillon de vin. Chaque solution est
ensuite diluée jusqu'à un volume donné avant de mesurer en absorption
atomique son absorbance.
fiole n°
|
0
|
1
|
2
|
3
|
4
|
volume échantillon de vin (mL)
|
10,00
|
volume de solution étalon S ( mL)
|
0
|
1,00
|
2,00
|
3,00
|
4,00
|
eau ultra pure
|
compléter la fiole jaugée de 50 mL au trait de jauge
|
absorbance mesurée A
|
0,005
|
0,039
|
0,070
|
0,104
|
0,139
|
CiE en ion cuivre (II) mg/L
|
x
|
0,2
|
0,4
|
0,6
|
0,8
|
Calculer les concentrations massiques volumiques CiE en ion cuivre (II) apportés par la solution étalon S dans chacune des fioles.
Fiole n°1 : 1,00 mL de S contient 10,00 / 1000 = 1,00 10-2 mg dans une fiole jaugée de 50,0 mL
C1E = 1,00 10-2 /0,050 =0,2 mg/L.
Démontrer, en supposant la loi de Beer-Lambert vérifiée, que l'absorbance de la solution Ai de la fiole i peut se mettre sous la forme Ai = a CiE + b avec a = K et b =KCdvin où Cdvin est la concentration massique en élément cuivre du vin dans les fioles préparées.
A = KCCu où A est l'absorbance, CCu la concentration totale en élément cuivre
Ai = K
(Cdvin +CiE ) = KCiE + KCdvin ;
Déterminer la concentration massique volumique en ions cuivre (II) dans le vin.
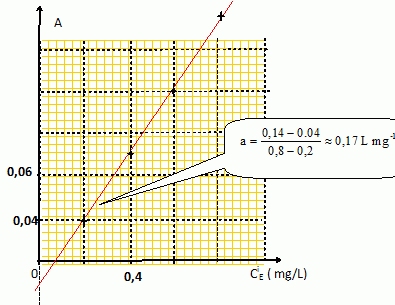
A = 0,171 CE + b ; 0,005 = 0,171 x 0 +b ; b = 0,005 = 0,171 Cdvin ; Cdvin= 0,03 mg/L.
Valeur inférieure à 0,8 mg/L : ce vin respecte la norme.
|
|




