Dosage
des ions cuivre (II) dans la bouillie bordelaise à 10 g/L.
La
bouillie bordelaise est constituée de 80 % en masse de sulfate de
cuivre pentahydraté et de 20 % en masse de chaux éteinte Ca(OH)2.
Calculer
les quantités de matière en hydroxyde de calcium et en sulfate de
cuivre pentahydraté dans 1,00 L de bouillie à 10 g/L.
2 g de chaux éteinte ; M(Ca(OH)2) =
40+2*17 =74 g/mol
n = m/M = 2 / 74 = 2,70 10-2 mol.
8 g de CuSO4, 5H2O; M =
63,5+32+4*16+5*18 = 249,5 g/mol
n = 8 / 249,5 = 3,21 10-2
mol.
Dans une fiole jaugée de 1,00 L, on introduit 10,0 g de bouillie
bordelaise et de l'eau permutée jusqu'au trait de jauge. La solution
obtenue n'est pas homogène. On filtre le mélange. Soit S0
le filtrat. On considèrera que le volume du filtrat est 1,00 L.
Mode opératoire.
Dans un becher de 150 mL introduire :
V4 = 10,0 mL de la solution S0
20 mL de tampon acétique à la concentration de 1,0 mol/L de pH = 4,8
80 mL d'eau bipermutée
10 gouttes de complexe HgY2- à 0,025 mol/L
Une électrode au calomel saturée et une électrode de mercure.
Titrer par une solution d'EDTA disodique ( 2 Na+aq+ H2Y2-aq ) de concentration C4 =5,00 10-3 mol/L.
Tracer la courbe décrivant l'évolution de la différence de potentiel entre les deux électrodes DE en fonction du volume V de solution d'EDTA dissodique versé.
|
Partie théorique :
Calculer la valeur du potentiel standard du couple HgY2- /Hg(l).
E°(Hg2+ /Hg(l))=0,86 V ; constante de formation globale log b(HgY2-) = 21,8.
Hg2+ aq + 2e- =Hg(l)
E1 = E°(Hg2+ /Hg(l))+0,03 log [Hg2+ aq]
Hg2+aq +H2Y2-aq = HgY2-aq +2H+aq.
b = [HgY2-aq][H+aq]2 /( [H2Y2-aq][Hg2+aq]) ;
E1 = E°(Hg2+ /Hg(l))+0,03 log([HgY2-aq][H+aq]2 /( [H2Y2-aq] b).
E1 = E°(Hg2+ /Hg(l))-0,03 log b +0,03 log([HgY2-aq][H+aq]2 /( [H2Y2-aq]). (1)
|
HgY2-aq +2H+aq +2e- = Hg(l) +H2Y2-aq
E2 = E°(HgY2- /Hg(l)) + 0,03 log ([HgY2-aq][H+aq]2 /[H2Y2-aq]). (2)
Identifier (1) et (2) : E°(HgY2- /Hg(l)) = E°(Hg2+ /Hg(l))-0,03 log b.
E°(HgY2- /Hg(l)) =0,86 -0,03 *21,8 =0,206 ~0,21 V.
Exprimer le potentiel de Nernst du couple HgY2- /Hg(l).
E = E°(HgY2- /Hg(l)) +0,03 log ([HgY2-aq][H+aq]2 /[H2Y2-aq]).
Indiquer pourquoi et à quelle condition une électrode de mercure est indicatrice de la concentration en Y4- et ne dépend que de cette concentration, à température fixée.
[HgY]2-=Hg2+
+Y4- ; (3)
Kd4 =
[Y4-][Hg2+]
/ [[HgY]2- ] soit
[Hg2+] =
Kd4[[HgY]2-
]/[Y4-]
E = E°(Hg2+/Hg) + 0,03 log
(Kd4[[HgY]2-
]/[Y4-])
avec
Kd4[[HgY]2-
] = constante notée A
E = E°(Hg2+/Hg) + 0,03 log A -0,03log
[Y4-]
et en posant B=E°(Hg2+/Hg) + 0,03 log A =
constante
E=B-0,03log
[Y4-].
La constante de formation globale log b(HgY2-) = 21,8 est très grande : la concentration [HgY]2-
] peut être considérée comme constante.
Les constante de formation de CaY2- et CuY2- sont inférieures.
Déduire de la courbe de dosage des ions calcium (II) par les ions [ HgY]2- ou cuivre (II) sont dosés en premier.
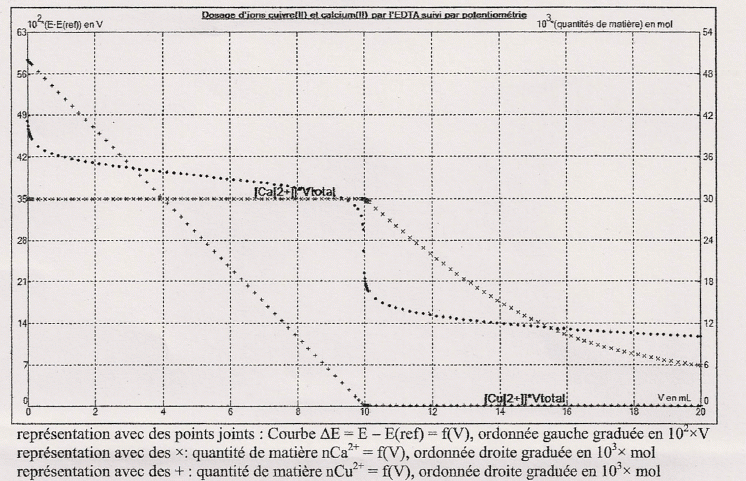
Les
ions cuivre (II) sont dosés en premier : la quantité de matière d'ion
cuivre (II) décroît jusqu'à s'annuler pour un volume V compris entre 0
et 10 mL alors que celle des ions calcium reste constante entre 0 et 10
mL.
La quantité de matière d'ion calcium décroît pour V supérieure à 10 mL.
Constantes globales de formation : log b(CuY2-) = 18,8 ; log b(CaY2-) = 10,7.
Ecrire la réaction de dosage des ions calcium (II) par les ions [ H2Y]2- . Calculer sa constante K1.
Ca2+aq +H2Y2- aq + 2CH3CO2-aq = CaY2-aq +2CH3CO2H aq.
K1 =[CaY2-aq][CH3CO2H aq]2 / ([Ca2+aq][H2Y2- aq][CH3CO2-aq]2).
Ca2+aq +H2Y2-aq = CaY2-aq +2H+aq.
b(CaY2-)= [CaY2-aq][H+aq]2 /( [H2Y2-aq][Ca2+aq]) ;
CH3CO2H aq = CH3CO2-aq +H+aq
Ka = [CH3CO2-aq][H+aq] /[CH3CO2H aq]
K1 = b(CaY2-)/ K2a.
K1 =1010,7 / (10-4,8)2 =2,0 1020.
Pour l'ion cuivre (II) on trouverait : K2 =1018,8 / (10-4,8)2 =2,5 1028.
K2 est bien supérieure à K1 : Cu2+aq +H2Y2- aq + 2CH3CO2-aq = CuY2-aq +2CH3CO2H aq est prépondérante.
On n'obseve pas de second saut de pH car l'eau doit se réduire avant l'ion calcium.
Donner les propriétés d'une solution tampon.
Une solution tampon modère les variations de pH consécutives à l'ajout
d'une petite quantité de base ou d'acide fort, et à une dilution
modérée.
En supposant que la concentration molaire volumique en ion cuivre (II) est de 5,0 10-3 mol/L dans S0,
montrer
par un calcul que la transformation chimique associée au dosage des
ions cuivre (II) est quantitative à la première équivalence, compte tenu de l'utilisation d'un tampon acétique de pH=4,8.
K2 =[CuY2-aq][CH3CO2H aq]2 / ([Cu2+aq][H2Y2- aq][CH3CO2-aq]2).
à pH maintenu à 4,8 : [CH3CO2H aq] =[CH3CO2-aq]
K2 =[CuY2-aq]/ ([Cu2+aq][H2Y2- aq]).
Le tableau ci-dessous a été réalisé à partir deu mélange initial correspondant aux quantités de réactifs à l'équivalence ::
|
avancement (mol)
|
Cu2+aq |
+H2Y2- aq |
+ 2CH3CO2-aq |
= CuY2-aq |
+2CH3CO2H aq |
initial
|
0
|
V4[Cu2+]
|
C4VE
|
constant
|
0
|
constant
|
en cours
|
x
|
V4[Cu2+]-x |
C4VE-x
|
tampon
|
x
|
tampon
|
équivalence
|
xE
|
V4[Cu2+]-xE=0 |
C4VE-xE=0 |
pH=4,8
|
xE |
pH=4,8
|
V4[Cu2+]-xE=C4VE-xE=0 ; V4[Cu2+] = C4VE ; [Cu2+] = C4VE / V4=5,00 10-3 * 10 / 10 = 5,0 10-3 mol/L.
[CuY2-aq]E = xE / Vtotal ; [Cu2+]E = [H2Y2- ]E ;
K2 =[CuY2-aq]E / [Cu2+]2E ; [Cu2+]2E = [CuY2-aq]E /
K2 ;
Hypothèse : [Cu2+]2E ~5 10-3 mol/L.
[Cu2+]2E =5 10-3 /2,5 1028 =2 10-31 ; [Cu2+]E =4,5 10-16 mol/L.
L'hypothèse est bien vérifiée ; la transformation est quantitative.
|
