Dosage
des ions cuivre (II) dans la bouillie bordelaise à 10 g/L.
La
bouillie bordelaise est constituée de 80 % en masse de sulfate de
cuivre pentahydraté et de 20 % en masse de chaux éteinte Ca(OH)2.
Calculer
les quantités de matière en hydroxyde de calcium et en sulfate de
cuivre pentahydraté dans 1,00 L de bouillie à 10 g/L.
2 g de chaux éteinte ; M(Ca(OH)2) =
40+2*17 =74 g/mol
n = m/M = 2 / 74 = 2,70 10-2 mol.
8 g de CuSO4, 5H2O; M =
63,5+32+4*16+5*18 = 249,5 g/mol
n = 8 / 249,5 = 3,21 10-2
mol.
Dans une fiole jaugée de 1,00 L, on introduit 10,0 g de bouillie
bordelaise et de l'eau permutée jusqu'au trait de jauge. La solution
obtenue n'est pas homogène. On filtre le mélange. Soit S0
le filtrat. On considèrera que le volume du filtrat est 1,00 L.
Quelques généralités sur les courbes intensité-potentiel.
Pour
tracer la courbe intensité-potentiel d'une solution S' de diiode sur
électrode de platine, on réalise le montage à trois élctrodes présenté
ci-dessous.
On rappelle qu'une solution de diiode est préparée à
partir d'une solution d'iodure de potassium et de cristaux de diiode et
que les espèces maoritaires en solutions sont K+, I- et I3-. Dans la solution S' étudiée, la concentration en ions triodure [I3-] vaut 0,10 mol/L et celle des ions iodure [I-] vaut 0,60 mol/L.
Schéma du montage à trois électrodes.
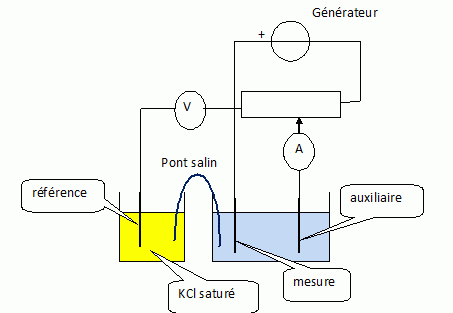
L'électrode de travail ( mesure ) doit être maintenue à un potentiel
constant : aucun courant électrique ne doit traverser l'électrode
de référence (sinon son potentiel serait modifié). Une troisième
électrode est donc nécessaire. Le courant circule alors entre
l'électrode de mesure et l'électrode auxiliaire ; le potentiel
est imposé entre l'électrode de mesure et l'électrode de référence.
On sépare physiquement l'électrode de référence de la solution à étudier.
|
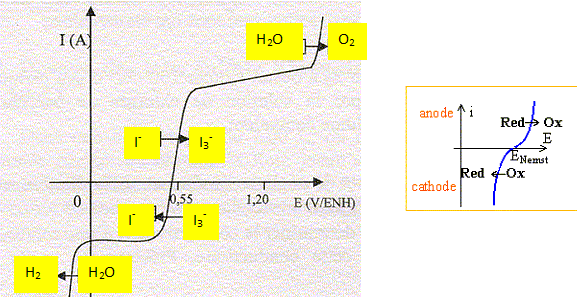
L'allure de la courbe intensité-potentiel est la suivante :
|
Dans certains ouvrages techniques, l'intensité est remplcée par la densité de courant j ( A m-2).
Quel intérêt pratique y a t-il à effectuer ce remplacement ?
L'intensité
mesurée dépend de la surface de l'électrode. En utilisant la densité de
courant, on s'affranchit de ce paramètre " surface de l'électrode".
L'allure des courbes est plus général.
Au
regard de la courbe expérimentale, quels systèmes redox peuvent être
considérés comme rapide ou lent dans ces conditions opératoires.
Justifier.
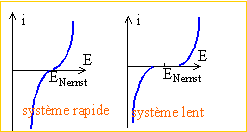
I3- / I- : ystème rapide ; H2O /H2 et O2/H2O : systèmes lents.
Le caractère lent ou rapide dépend essentiellement de la nature de l'électrode où se produit l'échange d'électrons.
Le système H+/H2 est rapide sur électrode de platine et lent sur électrode de graphite.
Deux paliers sont observés sur la courbe expérimentale.
Quel(s) phénomè(s) physique(s) est (sont) responsable(s) de la limitation du courant ?
Vitesse de diffusion des ions au voisinage des électrodes où se déroulent l'oxydation ou la réduction.
Le transport de matière est le facteur limitant : on observe un palier.
De quel(s) paramètre(s) dépend la hauteur d'un palier ?
Le courant limite (hauteur du palier ) est proportionnel à la concentration en réactif et au nombre d’électrons échangés.
Expliquer pourquoi les paliers ne sont pas observés dans les parties extrèmes gauche et droite de la courbe.
Réduction ou oxydation du solvant : il n'y a pas de limitation dû au transfert de matière.
La concentration de l'eau est telle que l'on ne peut pas atteindre un palier de diffusion.
Déterminer
d'un point de vue théorique le potentiel à courant nul de l'électrode
de platine plongeant dans la solution de diiode étudiée. Calculer sa
valeur.
I3- +2e- = 3 I- ; E = E°(I3- / I- ) + 0,03 log ([I3-] / [ I-]) =0,54 +0,03 log(0,10 / 0,60) =0,54-0,03 = 0,516~0,52 V.
Dosage du cuive (II) par iodométrie : suivi colorimétrique.
Dans un becher, introduire une prise d'essai V3 =25,0 mL de la solution S0. Ajouter 30 mL d'une solution d'iodure de potassium K+aq + I-aq à 100 g/L ( 0,600 mol/L ). Attendre 10 minutes.
Titrer par une solution de thiosulfate de sodium ( 2Na+aq + S2O32-aq) de concentration C3 = 1,00 10-2 mol/L en ion thiosulfate.
Ecrire
l'équation de la réaction traduisant la transformation chimique
observée dans le becher avant ajout de thiosulfate de sodium.
Un précipité d'oxyde de cuivre (I) se forme : 3I-aq +Cu2+aq = CuI(s) + I3-aq. (1)
La couleur jaune brun de la solution est due à l'ion I3-aq.
Ecrire l'équation de la réaction du dosage.
I3-aq +2S2O32-aq = 3I-aq + S4O62-aq.
Comment peut-on bien visualiser l'équivalence ?
I3-aq
est la seule espèce colorée : avant l'équivalence, ajouter de l'empois
d'amidon, ce dernier réagit avec le diiode pour donner une coloration
violette assez foncée.
A.N : Ve4 = 12,4 mL.
A l'équivalence n(S2O32-aq) = 2 n(I3-aq) ; n(I3-aq) =½C3Ve4 = 0,5 * 1,00 10-2 *12,4 10-3 =6,2 10-5 mol.
D'après (1) la quantité de matière d'ion cuivre (II) vaut : n(Cu2+aq) = n(I3-aq) =6,2 10-5 mol dans 25,0 mL.
[Cu2+aq] =6,2 10-5 / 0,025 =2,48 10-3 mol/L.
Dosage des ions cuivre (II) par iodométrie : suivi par potentiométrie.
La méthode colorimétrique n'est pas toujours adaptée au dosage du
cuivre (II), soit parce que les solutions sont trop peu concentrées,
soit parce que l'équivalence n'est pas détectable facilement
visuellement. Les méthodes potentiométriques peuvent s'avérer des
méthodes de choix pour des concentrations pas trop faibles (
supérieures ou égales à 10-3 mol/L).
Etude théorique préliminaire :
Quatre
courbes intensité-potentiel sur électrode de platine ont été tracées
pour différents volumes V de solution de thiosulfate de sodium versé au
cours de l'expérience précédente. Soit pour V=0 ; V < Ve ; V=Ve ; V > Ve. Ve représente le volume de solution de thiosulfate de sodium versé à l'équivalence.
Après avoir déterminé les espèces prédominantes électroactives, justifier l'allure des courbes ?
Les ions tétrathionate ne sont pas électroactifs dans l'eau sur électrode de platine, CuI(s) n'intervient pas. Le couple S4O62-aq / S2O32-aq est lent sur électrode de platine.
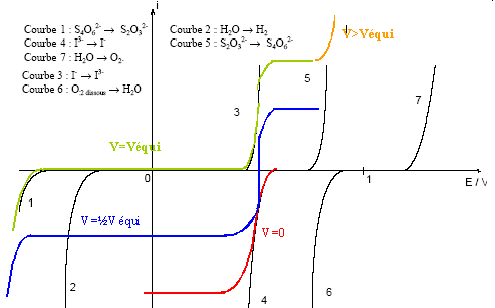
V=0 : I-aq ; I3-aq sont présents : le couple I3-aq / I-aq fixe le potentiel.
V < Ve ; [I3-aq] diminue, [I-aq] augmente, les ions S4O62-aq sont présents et S2O32-aq est en défaut. L'intensité du courant
|iC| diminue linéairement avec
[I3-] lors de l'ajout du
thiosulfate.
V=Ve : les ions S4O62-aq et I-aq sont présents. |iC| s'annule.
V > Ve : les ions S4O62-aq et I-aq sont présents et l'ion S2O32-aq est en excès ( S2O32-aq s'oxyde ) : le couple S4O62-aq / S2O32-aq fixe le potentiel.
Dosage potentiométrique à courant nul :
On introduit dans le becher une électrode au calomel saturé et une électrode de platine, la différence de potentiel DE entre les deux électrodes est mesurée au cours du dosage, de façon à pouvoir tracer DE
= f(V) où V est le volume de la solution de thiosulfate de sodium. On
observe qu'après l'équivalence la différence de potentiel mesurée n'est
pas stable. Le relevé des mesures n'est possible qu'avant l'équivalence.
Expliquer pourquoi à l'aide des courbes intensité-potentiel.
Le couple S4O62-aq / S2O32-aq est lent sur électrode de platine. Le potentiel de l’électrode à intensité nulle n’est pas bien défini.
Un système lent ne peut pas être utilisé pour réaliser un dosage potentiométrique à courant nul.
Dosage potentiométrique à courant imposé.
On introduit dans le becher deux électrodes de platine dans lesquelles
circule un courant très faible de l'ordre de 1 µA. L'une des électrodes
joue le rôle d'anode et l'autre de cathode. La différence de potentiel
DE entre ces deux électrodes est mesurée au cours du dosage, de façon à
pouvoir tracer DE = f(V).
Pourquoi le courant imposé est-il si faible ?
Les quantités de substances électrolysées doivent être négligeables par rapport aux quantités à doser.
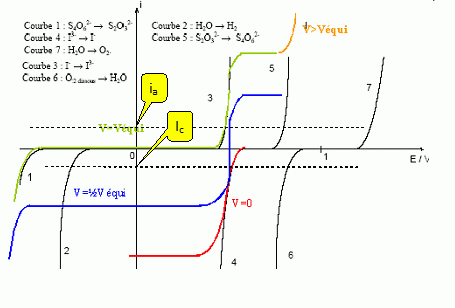
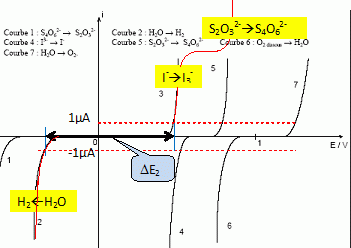
Représenter ia et ic respectivement courant anodique et cathodique qui circulent dans les électrodes.
Le tracé sera réalisé sur la courbe obtenue en V=0 ; echelle : 3 mm pour 1 µA.
|
A
l'aide du faisceau de courbes intensité-potentiel, on souhaite prévoir
l'allure de la courbe de titrage que l'expérimentateur devrait obtenir.
Déterminer l'ordre de grandeur de DE0, différence de potentiel entre anode et cathode pour i=1 µA à V=0.
Anode : oxydation de I-aq ; cathode : réduction de I3-aq:
Le système I3-aq / I-aq étant rapide, DE0 ~ 0 V.
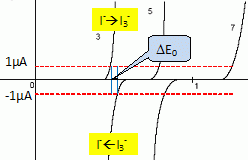
Déterminer l'ordre de grandeur de DE1, différence de potentiel entre anode et cathode pour i=1 µA à V < Ve.
L'ion thiosulfate est en défaut.
Le système I3-aq / I-aq étant rapide, DE1 ~ 0 V.
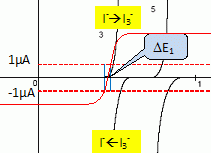
Déterminer l'ordre de grandeur de DEé, différence de potentiel entre anode et cathode pour i=1 µA à V = Ve.
I3-aq a disparu ; l'ion thiosulfate est en défaut ;
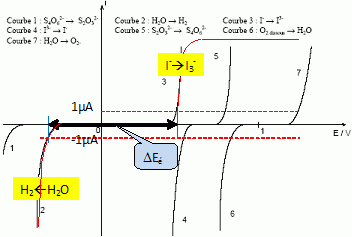
Déterminer l'ordre de grandeur de DE2, différence de potentiel entre anode et cathode pour i=1 µA à V> Ve.
I3-aq a disparu ; l'ion thiosulfate est en excès ;
En déduire l'allure de la courbe de titrage.
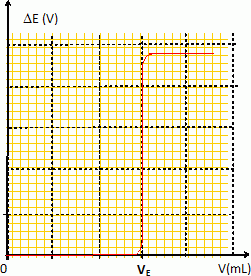
L'équivalence est repérée par la variation brutale de DE.
La variation DE étant très rapide, il faut resserer les mesures autour du point équivalent.
|









