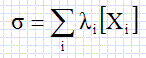Dosage des ions sulfate libres dans la bouillie bordelaise à 10 g/L.
La
bouillie bordelaise est constituée de 80 % en masse de sulfate de
cuivre pentahydraté et de 20 % en masse de chaux éteinte Ca(OH)2.
Le sulfate de cuivre est obtenu par dissolution de l'oxyde de cuivre (II) par l'acide sulfurique.
Ecrire l'équation bilan de cette réaction.
CuO(s) + H2SO4 = CuSO4 + H2O.
Calculer les quantités de matière en hydroxyde de calcium et en sulfate de cuivre pentahydraté dans 1,00 L de bouillie à 10 g/L.
2 g de chaux éteinte ; M(Ca(OH)2) = 40+2*17 =74 g/mol
n = m/M = 2 / 74 = 2,70 10-2 mol.
8 g de CuSO4, 5H2O; M = 63,5+32+4*16+5*18 = 249,5 g/mol
n = 8 / 249,5 = 3,21 10-2 mol.
Dans une fiole jaugée de 1,00 L, on introduit 10,0 g de bouillie
bordelaise et de l'eau permutée jusqu'au trait de jauge. La solution
obtenue n'est pas homogène. On filtre le mélange. Soit S0 le filtrat. On considèrera que le volume du filtrat est 1,00 L.
Etalonnage d'une solution de chlorure de baryum par pHmétrie.
A une prise d'essai de volume V1 = 20,0 mL d'une solution de chlorure de baryum ( Ba2+aq + 2Cl-aq) de concentration C1 en ion baryum, ajouter 0,10 g de dichromate de potassium. Titrer par une solution d'hydroxyde de sodium de concentration C2 = 6,00 10-2 mol/L.
Quelles électrodes sont nécessaires à la réalisation d'un dosage pH-métrique.
On utilise une électrode au calomel saturée ( référence) et une électrode de
verre( mesure) ou encore une électrode combinée.
On suppose que la concentration C1 est de l'ordre de 3,0 10-2 mol/L. On réalise la courbe simulée de ce dosage : les volumes équivalents sont notés Vé1 et Vé2 avec Vé1 < Vé2.
Calculer
les quantités de matière en ion baryum et en ion dichromate avant toute
transformation chimique dans le becher du dosage.
n Ba2+ = C1V1 = 3,0 10-2 * 20 10-3 = 6,0 10-4 mol
n dichromate = m / M = 0,10 / 294 = 3,4 10-4 mol
Ecrire la réaction chimique entre les ions baryum et les ions dichromate qui entraîne la formation d'un précipité BaCrO4. Calculer sa constante d'équilibre K.
On donne : Cr2O72- aq +3H2O(l) = 2 CrO42- aq + 2H3O+aq : K1 = 10-14,7 ; pKs(BaCrO4) = 9,9.
2Ba2+aq + Cr2O72- aq +2HO-aq= 2Ba CrO4 (s) + H2O(l).
En milieu acide : 2Ba2+aq + Cr2O72- aq +3H2O(l)= 2Ba CrO4 (s) + 2H3O+aq.
K = [H3O+]2 / ([Cr2O72-][Ba2+]2).
K1 =[CrO42-]2[H3O+]2 / [Cr2O72-]
Par suite K = K1 / ( [CrO42-]2 [Ba2+]2 )
Ks(BaCrO4) =[Ba2+][CrO42-] = 10-9,9.
par suite K = K1 / K2s =10-14,7 / (10-19,9 ) =1,6 105.
|
La transformation étant quantitative, établir un tableau d'avancement.
|
avancement (mol)
|
2Ba2+aq |
+ Cr2O72- aq |
+2HO-aq |
2Ba CrO4 (s) |
+ H2O(l) |
initial
|
0
|
6,0 10-4 |
3,4 10-4 |
n
|
0
|
solvant
|
en cours
|
x
|
6,0 10-4-2x |
3,4 10-4-x |
n-2x
|
2x
|
large
|
fin
|
xM
|
6,0 10-4-2xM |
3,4 10-4-xM |
n-2xM |
2xM |
excès
|
|
Calculer la valeur du pH initial dans le becher avant ajout de la solution titrante d'hydroxyde de sodium.
2Ba2+aq + Cr2O72- aq +3H2O(l)= 2Ba CrO4 (s) + 2H3O+aq. K est grand, la réaction est totale.
| avancement (mol) | Cr2O72- aq | +2Ba2+aq |
+3H2O(l) | = 2Ba CrO4 (s) | + 2H3O+aq | | initial | 0 | 3,4 10-4 | 6,0 10-4 |
solvant | 0 | 0 | | en cours | x | 3,4 10-4-x | 6,0 10-4-2x |
large | 2x | 2x | | équilibre | xF | 3,4 10-4-xF | 6,0 10-4-2xF |
excès | 2xF | 2xF |
[H3O+] = 2xF /0,02 =100xF ; [Cr2O72-]~3,4 10-4/0,02 -xF / 0,02= 0,017 - 50xF mol/L
[Ba2+aq]~6,0 10-4/0,02 -2xF / 0,02= 0,03 - 100xF mol/L
K = [H3O+]2 / ([Cr2O72-][Ba2+]2) = 104x2F / ((0,017 - 50xF)(0,03 - 100xF)2) = 1,6 105.
La réaction est totale et Ba2+aq est en défaut : 6,0 10-4-2xF ~0 ; xF ~3,0 10-4mol.
[H3O+] = 100xF =3,0 10-2mol /L ; pH ~ -log 3,0 10-2 = 1,5.
Exprimer la relation permettant de calculer C1 en fonction du volume équivalent Ve1.
Equation de la réaction de dosage : 2Ba2+aq + Cr2O72- aq +2HO-aq= 2Ba CrO4 (s) + H2O(l).
A l'équivalence les quantités de matière d'ion baryum et d'ion hydroxyde sont en proportions stoecchiométriques :
C1V1 =C2 Ve1 ; C1 = C2 Ve1 / V1.
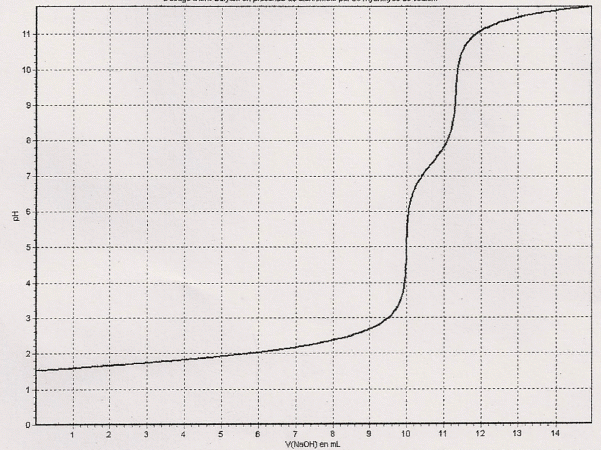
A.N : Ve1 = 10,1 mL ; Ve2 =11,5 mL.
C1 = 6,00 10-2 *10,1 / 20,0 =3,03 10-2 mol/L.
Si DC/ C1 =0,01 ( 1%) alors DC =3 10-4 ; C1 =3,03 10-2 + ou - 3 10-4 mol/L.
Quelle réaction de dosage a lieu pour un volume versé compris entre Ve1 et Ve2.
L'ion dichromate est en excès ; Cr2O72- aq +3H2O(l) = 2 CrO42- aq + 2H3O+aq ;
H3O+aq + HO-aq= 2H2O(l) Ke = 1014, est la réaction prépondérante.
ou encore Cr2O72- aq +2HO-aq = 2 CrO42- aq + H2O(l).
Dosage conductimétriques des ions sulfates.
Le but est de déterminer la concentration CSO42- en ions sulfate de la solution S0.
A la prise d'essai V2 = 50,0 mL de solution S0
à doser, ajouter 150 mL d'eau permutée. Introduire la cellule
conductimétrique. Titrer par la solution de chlorure de baryum de
concentration C1 = 3,00 10-2 mol/L. Soit Ve3
le volume équivalent. L'ajout de 150 mL d'eau permutée permet de
négliger l'influence de la dilution sur la valeur de la conductivité.
Quel est l'intérêt de se placer dans ces conditions ?
Tout
d'abord l'extrémité de la sonde de mesure est correctemment
immergée ; ensuite la courbe obtenue est constituée de deux segments de
droite.
Donner la relation générale permettant de déterminer la conductivité s d'une solution en fonction des espèces responsables de cette conductivité.
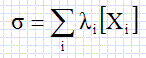
li : conductivité molaire ionique d'un ion ( S m2 mol-1) ; [Xi] : concentration des ions ( mol m-3) ; s : conductivité ( S m-1).
Avant l'équivalence, la conductivité s peut se mettre sous la forme s = A+B V, A et B étant des constantes et V le volume de la solution de chlorure de baryum ajouté.
Donner l'expression de B. En déduire l'évolution de la conductivité avant l'équivalence.
Le terme A fait référence aux ions dont la concentration reste constante.
Le terme B prend en compte les ions dont la concentrations varie : ions ajoutés Ba2+aq et 2Cl-aq ; ion dosés SO42-aq.
Avant l'équivalence l'ion baryum est en défaut dans le becher.
[Cl-aq] = 2 C1 V / Vtotal = 2 C1 V / 0,2 =10C1 V ( avec V en litre).
| avancement (mol) | Ba2+aq | + SO42-aq | = BaSO4(s) | | initial | 0 | C1Ve3 | CSO42-V2 | 0 | | avant équivalence | x =C1V | C1Ve3-x | CSO42-V2-x
=CSO42-V2-C1V | x =C1V |
[SO42-aq] =(CSO42-V2-C1V ) / 0,2 = 5CSO42-V2 - 5C1V ; ( le terme 5CSO42-V2 constant fait partie de A.
B = lCl- [Cl-aq] + lSO42- (- 5C1V ) = lCl-10C1 V - lSO42- 5C1V = 5C1 (2lCl- - lSO42- ) V.
Du point de vue de la conductivité, tout revient à remplacer un ion sulfate par deux ions chlorure.
B = 5C1 (2*7,6 -16 )10-3 V = -4 10-3 C1V. B est négatif et petit, la conductivité diminue lentement. A partir d'une étude qualitative de l'évolution des espèces, prévoir l'allure de la courbe de dosage s= f(V) après l'équivalence.
Après
l'équivalence, l'ion baryum est en excès. On ajoute des ions baryum et
des ions chlorure : la conductivité de la solution augmente assez vite.
A.N : Ve3 = 13,3 mL.
A l'équivalence : C1Ve3 =CSO42-V2. CSO42-= C1Ve3 / V2 = 3,00 10-2 *13,3 / 50,0 =7,98 10-3 mol/L.
|
En
supposant que les ions sulfate qui n'ont pas été dosés sont dans le
résidu de filtration de la bouillie bordelaise sous forme de précipité
de sulfate de calcium, évaluer la concentration en ions calcium libre dans S0.
Dans 1 L de S0 :
7,98 10-3 mol d'ion sulfate libre ;
2,70 10-2 mol d'ion calcium apporté par la chaux éteinte.
3,21 10-2 mol d'ion sulfate issu du sulfate de cuivre.
Donc : 3,21 10-2 - 7,98 10-3 =2,41 10-2 mol de sulfate dans le solide CaSO4.
2,41 10-2 mol de calcium dans le solide CaSO4.
2,70 10-2 - 2,41 10-2 =2,9 10-3 mol d'ion calcium dans 1 L de S0.
En déduire une valeur approchée du produit de solubilité du sulfate de calcium.
Ks(CaSO4) = CSO42- [Ca2+] =7,98 10-3 *2,9 10-3= 2,3 10-5 ; pKs ~ 4,6.
.
|
|