Obtention
de la chaux vive.
Elle est obtenue par calcination du calcaire CaCO3 dans un
four à chaux vers 900 °C.
CaCO3(s) = CaO(s) + CO2(g). (1)
Le tracé des courbes enthalpie libre standard de formation DrG°, en fonction de la
température pour les espèces CO2(g), CaCO3(s) et CaO(s) est
donné :
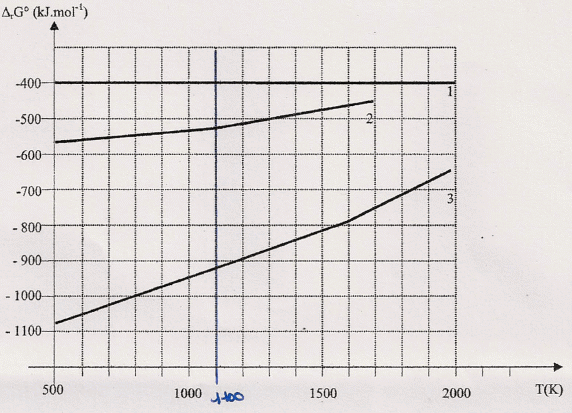
Quelle(s)
hypothèse(s) ont été formulée(s) pour que des portions de droites
soient obtenues ?
On se place dans le cadre de l'approximation
d'Ellingham : l'entropie DrS° et l'enthalpie DrH° étant supposées indépendantes de
la température ; les courbes d'équation DrG°(T)
= DrH° - T DrS° sont des segments de droites.
Les ruptures de pente correspondent à des changements d'états physiques.
Quelle
courbe est relative à CO2 ? Justifier.
|
CaCO3(s) |
CaO(s)
|
Ca(s)
|
température
de fusion TF (K)
|
1615
|
2885
|
1115
|
température
d'ébullition TE(K)
|
|
|
1757
|
courbe 1 : pas de
rupture de pente, courbe correspondant à C(s) + O2(g)
-->CO2(g). De plus cette courbe à une pente nulle.
Retrouver l'équation
de la courbe relative à la formation de CaO (s) pour une température
comprise entre 500 K et 1115 K.
|
DfH° ( kJ/mol)
|
S° ( J
K-1 mol-1)
|
Ca(s)
|
0
|
41,7
|
CaO
(s)
|
-633
|
40,3
|
O2(g)
|
0
|
204,8
|
CaCO3(s)
|
-1207
|
92,9
|
CO2(g)
|
-393
|
213,8
|
2Ca(s) + O2(g) = 2CaO(s)
Le dioxygène y apparaît avec le coefficient stoechiométrique égal à 1.
DrH°
= 2DfH°(CaO) - DfH°(O2) -2DfH°(Ca) = -2*633 =
-1266 kJ mol-1.
DrS° = 2S°(CaO) - S°(O2) -2S°(Ca) = 2*40,3-204,8-2*41,7=
-207,6 J K-1mol-1.
DrG° = DrH° -T DrS° = -1,266 106
+ 207,6 T pour 1 mole de dioxygène et 2 moles de CaO(s).
DrG° = -6,33 105
+ 103,8 T pour une mole de CaO(s)
|
Retrouver l'équation
de la courbe relative à la formation de CaO (s) pour une température
comprise entre 1115 K et 1750 K.
Enthalpie standard de fusion du calcium : DfusH° =9,4 kJ mol-1.
DrH°
= 2DfH°(CaO) - DfH°(O2) -2DfH°(Ca) - 2DfusH°(Ca)
= -2*633 -2*9,4 = -1285 kJ mol-1.
entropie de changement d'état du calcium à 1115 K : DfusH°
/ T = 9400 / 1115 =8,43 J K-1mol-1.
DrS° =
2S°(CaO) - S°(O2) -2S°(Ca)-2 DfusH°
/ T= 2*40,3-204,8-2*41,7-2*8,43= -224,5 J K-1mol-1.
DrG° =
DrH° -T DrS° = -1,285 106
+ 224,5 T pour 1 mole de dioxygène et 2 moles de CaO(s).
DrG° = -6,42 105
+ 112 T pour une mole de CaO(s)
La courbe 2 peut correspondre à : Ca + ½O2(g) = CaO(s) ( rupture de
pente à 1115 K, et les enthalpies libres du graphe
correspondent s aux valeur calculées)
La courbe 3 correspond à : Ca(s) + 1,5O2(g) = CaCO3(s).
|
On considère le
système triphasé CaCO3(s), CaO(s) et CO2(g)
où les deux solides ne sont pas miscibles.
Calculer
la variance du système. Commenter.
2 constituants indépendants : 3 constituants - une relation ; 3 phases.
v = 2+2-3 = 1; monovariant, seul un paramètre physique peut être
modifié, température ou pression, sans rupture de l'équilibre.
Soit T1 la température à laquelle les 3 espèces
peuvent coexister sous PCO2 = 1 bar.
Calculer
DrG°(T1).
CaCO3(s)
= CaO(s) + CO2(g) ; constante d'équilibre K = PCO2
= 1.
DrG°(T1)
= -RT ln K = -RTln 1 = 0.
DrH° = DfH°(CaO) + DfH°(CO2)
-DfH°(CaCO3) =
-633-393+1207 = 181 kJ mol-1.
DrS°
= S°(CaO) + S°(CO2) -S°(CaCO3)
= 40,3+213,8-92,9= -161,2 J K-1mol-1.
DrG° = DrH° -T DrS° = 1,81 105
- 161,2 T.
1,81 105 -161,2 T1 = 0 ; T1 =1,12 103
K.
Sur le graphe, la verticale telle que DrG° =0 correspond à T1 ~ 1100 K Le four à chaux est un réacteur ouvert à la pression atmosphérique et à
une température T2 légèrement supérieure à T1.
Exprimer l'enthalpie
libre standard de la réaction (1) à la température T2 en fonction de
l'enthalpie libre standard de la réaction (1) et du quotient de
réaction Q.
Q = PCO2 ; DrG°(T2)
= DrG°(T1)
+ RT2 ln Q = DrG°(T1)
+ RT2 ln PCO2.
DrG°(T1) =
-RT1 ln Qéq = -RT1 ln PCO2
éq.
DrG° = DrH° -T DrS° = 1,81 105
- 161,2 T.
Si la température augmente, DrG°
diminue.
DrH° est positive, la
réaction est endothermique.
Sous P fixée à 1 bar et en travaillant à la température T2
supérieure à T1, l'équilibre est rompu : la réaction dans le
sens direct, formation de CaO, est favorisée.
Le
cristal d'oxyde de calcium.
C'est un cristal ionique qui cristallise dans le système de type chlorure de sodium..
Donner
la structure électronique à l'état fondamental de l'atome de calcium,
après avoir énoncé les règles qui permettent de l'établir.
Règle de Pauli : deux électrons se
différencient par au moins l'un de leur nombres
quantiques n, l, m et s.
Règle de Klechkowski : l'ordre de
remplissage des orbitales se fait suivant (n+l) croissant ;
si deux orbitales atomiques ont le même nombre (l+n),
celle qui a la plus faible valeur de n est remplie en
premier ( principe de stabilité)
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f...
Règle de Hund : cas des orbitales de
mêmes énergie.
Les électrons de spins parallèles occupent
le maximum d'orbitales.
20 Ca : 1s2 2s2 2p6 3s2 3p6 4s2 .
L'atome de calcium perd facilement deux électrons et donne l'ion Ca2+
dans lequel la couche électronique externe est complète. Le nombre
d'oxydation du calcium dans l'ion calcium est +II, égal à la charge de
l'ion simple.
Représenter la maille de CaO.
cristaux type NaCl :
Deux réseaux cubiques à faces
centrées, l'un d'ion Na+, l'autre d'ion
chlorure Cl-. Ces réseaux se
déduisent l'un de l'autre par translation
parallèle aux arètes de la maille et de valeur
égale à la moitié du coté de la
maille.
Chaque ion est au centre d'un octaèdre,
entouré de 6 ions de signe opposé occupant les
6 sommets.
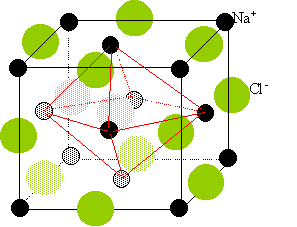
Déterminer le nombre d'ions présents dans la maille CaO. Déterminer le nombre de motifs par maille.
Chaque ion situé au sommet du cube est commun à huit mailles, il compte pour 1/8.
Les ions situés sur les huit sommets comptent pour 1/8 *8 = 1.
Chaque ion situé au centre d'une face est commun à 2 mailles : il compte pour 1/2.
Les 6 ions situés aux centres des 6 faces comptent pour 1/2*6 = 3.
Il y a donc 4 ions calcium et 4 ions oxyde par maille.
Définir la coordinence.
C'est le nombre d'ions de signe opposé entourant
chaque ion, il est ici de six.
Chaque ion peut être considéré comme
étant au centre d'un octaèdre dont les six
sommets sont occupés par des ions de signe
opposé.
Etablir la relation littérale permettant d'accéder à la masse volumique r du cristal CaO. Calculer sa valeur.
Paramètre de la maille a = 481 pm ; rayon du cation r+ =99 pm.
La maille compte en propre 4 motifs CaO.
masse de la maille : 4 * masse molaire CaO
(kg/mol) / nombre
d'Avogadro m = 4 MNaCl / NA.
volume de la maille V =a3. (en m3)
masse volumique (kg/m3 ) : r = m /V=4 MCaO / (a3NA)
r =4*56 10-3 / ((481 10-12)3 * 6,023 1023) =3,34 103 kg/m3.
|
Déterminer une relation entre les rayons ioniques et le paramètre de la maille. Calculer r.
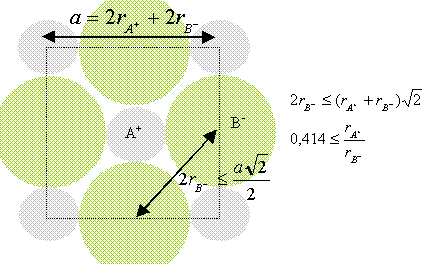
a = 2(r+ + r-) ; r-= ½a - r+ =481/2 -99 =141,5 ~142 pm.
Définir puis calculer la compacité du cristal.
C'est le rapport entre le volume occupé par les ions et le volume de la maille.
Volume des ions ( sphère) : 4 *4*p /3[r-3+r+3]
Volume de la maille: a3 ;
compacité : C = 4 *4*p /3[r-3+r+3] / a3
C = 16*3,14/3 [141,53 + 993] 10-36 / (481 10-12)3 =0,572.
Obtention de la chaux éteinte.
On ajoute de l'eau à la chaux vive.
CaO(s) + H2O(l) = Ca(OH)2 DfH° =-65,5 kJ/mol.
Calculer la valeur du volume d'eau ( m3) nécessaire à l'hydratation d'une tonne de chaux vive.
n(CaO) = m / M = 106 / (40+16) = 1,786 104 mol.
n(CaO) = n(H2O) ; m(eau) = n(H2O) * M(eau) = 1,786 104 x 18 10-3 =321 kg ( ou 0,321 m3)
la réaction est exothermique : une petite partie de l'eau se vaporise ; il vaut donc mieux ajouter 0,3 m3 d'eau supplémentaire.
|
|


