|
|
On
peut estimer qu'entre 20 et 30 % du PNB de la plupart des pays
industrialisés sont directement issus de la catalyse, et cette part est
en croissance puisque les procédés catalytiques en général sont moins
consommateurs d'énergie et produisent moins de polluants.
Le carbure de silicium est un matériau dont les propriétés physiques et
chimiques particulières permettent l'utilisation comme support de phase
active en catalyse hétèrogène.
Structure
cristalline du carbure de silicium.
le carbure de silicium existe sous de nombreuses formes cristallines (
polytypes). La phase ß cristallise dans le réseau cubique CFC du type
blende. On donne rSi=115 pm et rC =77 pm.
Décrire et dessiner la maille
cristalline représentative du solide SiC.
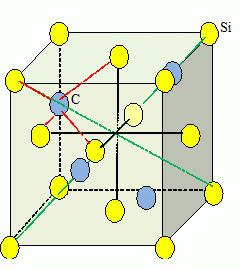
Les atomes de silicium occupent les sommets et les centres des faces du
cube.
Les atomes de carbone occupent la moitié des sites tétraèdriques.
Quelles sont les
coordinences de Si et C dans cette structure ?
Chaque atome de carbone a 4 atomes de silicium comme plus proches
voisins.
Chaque atome de silicium a également 4 atomes de carbone comme plus
proches voisins.
La coordinence est de 4.
Quel
type d'interaction assure la cohésion d'un tel solide ?
Les atomes de silicum et de carbone sont liés par des liaisons de
covalence.
Donner la
relation entre a, paramètre de la maille et les rayons des deux atomes.
Il y a contact entre deux atomes ( supposés sphériques ) de carbone et de silicium sur un quart de la grande
diagonale du cube.
La grande diagonale mesure : 3½a.
rC +rSi = 3½a / 4.
|
|
Définir et calculer
la compacité d'une telle structure. Commenter le résultat.
On calcule la compacité en divisant le volume des atomes par le volume
de la maille.
Chaque maille compte en propre 4 atomes de carbone et 4 atomes de
silicium.
Volume des atomes : 4[4/3 pi (rC3 +rSi3 )]
4*4*3,14 / 3 ( 1153 + 773) 10-36 =3,31
10-29 m3.
coté du cube : a = 4( rC +rSi ) 3-½
=4(115+77) 10-12* 3-½ ;
a = 4,43 10-10 m
Volume du cube : a3 =8,72 10-29 m3.
Compacité : 3,31 / 8,72 =0,38.
La structure est peu compacte.
|
Calculer la masse
volumique du carbure de silicium en g cm-3.
Masse de 4 atomes de
carbone : 4 *MC / NA = 4*12/6,02 1023
=7,973 10-23 g
Masse de 4 atomes de
silicium : 4 *MSi / NA = 4*28/6,02 1023
=1,860 10-22 g
Masse d'une maille : 2,67 10-22 g.
Volume de la maille : 8,72
10-29 m3= 8,72 10-23 cm3.
masse volumique : 2,67 10-22
/ 8,72 10-23 =3,06
~3,1 g cm-3.
Préparation du
carbure de silicium.
Le procédé industriel courant de préparation du carbure de silicium (
utilisé comme additif ou abrasif dans les céramiques ) consiste
en une réaction de carboréduction de la silice vers 1800 °C :
SiO2(liq) + 3C(s) = SiC(s) + 2 CO(g) réaction (1).
Que
signifie l'approximation d'Ellingham ?
On se placera dans le cadre de cette approximation dans toute la
suite.
L'enthalpie standard de
réaction et l'entropie standard DrS°
de la réaction ne dépendent pas de la température.
Quelle
est l'influence d'une augmentation de température sur la constante de
cet équilibre ?
On donne :
|
SiC(s)
|
SiO2(liq)
|
C(s) |
CO(g) |
DfH kJ mol-1
|
-65
|
-903
|
0
|
-111
|
S°
J K-1 mol-1
|
17
|
46
|
6
|
198
|
DrH° =DfH(SiC(s)) + 2 DfH(CO(g)) - DfH (SiO2(l))
-3DfH(C)
DrH° =-65 + 2*(-111) -
(-903) = 616 kJ mol-1.
Cette valeur étant positive, la réaction est endothermique dans le sens
direct.
Dans le sens direct cette réaction est favorisée par une élévation de
température. La constante d'équilibre augmente avec la température.
Donner
l'expression de l'enthalpie libre standard de cette réaction en
fonction de la température.
DrS° =S(SiC(s)) + 2 S(CO(g)) - S (SiO2(l)) -3S(C)
DrS° =17 + 2*198-3*6 -
46 = 349 J K-1mol-1.
DrG° = DrH° -T DrS° =6,16 105 -349 T en J
mol-1.
On
demande souvent aux étudiants le calcul de la température d'inversion.
Définir
cette température.
A cette température Ti, l'enthalpie libre de la réaction est
nulle.
A une température inférieure à Ti,
DrG° est positive : la
réaction est défavorisée thermodynamiquement.
A
une température supérieure à Ti,
DrG° est négative : la
réaction est favorisée thermodynamiquement.
Ti
=6,16 105 / 349 = 1765 K.
Le processus industruiel est conduit à une température supérieure à Ti
: dans ce cas la réaction est favorisée.
Calculer
la variance du système à l'équilibre.
Nombre de constituants : 4 ; nombre de relations entre les constituants
: 1
Nombre de phases : 2 solides, un liquide et un gaz.
Nombres de facteurs physique : température et pression (2)
Variance : 4-1+2-4 = 1.
On ne peut donc agir que sur un seul facteur physique, sans rompre
l'équilibre.
On maintient la température constante et l'on diminue la pression.
Quel
est l'effet sur l'équilibre ? Quel est l'intérêt de cette méthode ?
En diminuant la pression , on déplace l'équilibre dans le sens direct,
c'est à dire augmentation du nombre de molécules de gaz.
Mais aussi formation du carbure de silicium.
Par ce procédé, la surface spécifique du
carbure de silicium est faible.
Définir ce terme de
surface spécifique et expliquer en quoi cela constitue un inconvénient
pour son utilisation comme support de catalyseur.
On calcule la surface spécifique en divisant la superficie réelle du
solide par sa masse.
Plus la superficie réelle est grande, plus il existe de sites
potentiels pour adsorber des espèces et plus la réaction chimique
catalysée ( catalyse hétérogène) sera rapide.
|
|
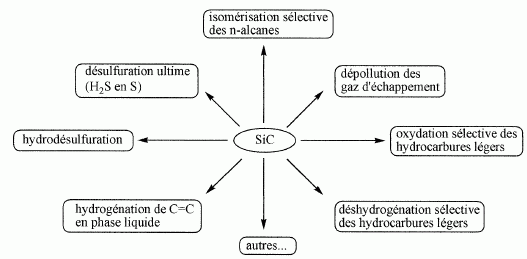
Utilisations.
Le schéma suivant présentes différentes réactions catalytiques
utilisant le carbure de silicium comme support de phase active. Il
pourrait être présenté à des élèves de terminale S en fin
d'année,
afin de proposer une synthèse partielle de notions vues en première et
en terminale.
|
.
|
|