|
|
Pour
décrire l'accumulation d'une substance dans un milieu biologique
déterminé, on utilise le facteur de bioaccumulation ( FBC) défini comme
le rapport de la concentration ou teneur en composé dans un être vivant
sur la concentration ou teneur en ce même composé dans le milieu
environnant.
Dans
la pratique, on
manque souvent de données pour déterminer les valeurs de FCB (
facteur de bioaccumulation )des substances telles que les
hydrocarbures chlorés.
On détermine dans ce cas les coefficients de partages octan-1-ol / eau,
l'eau et l'octan-1-ol étant supposés totalement non miscibles :
POW = [X]octanol / [X]eau.
On donne quelques valeurs de log
POW.
benzène
|
chlorobenzène
|
hexachlorobenzène
|
pentachlorophénol
|
acétone
|
éthanol
|
2,13
|
2,84
|
6,18
|
5,01
|
-0,24
|
-0,32
|
En supposant que les composés
organiques s'acumulent surtout dans les tissus adipeux, peut-on établir
un lien entre l'évolution du FCB et celle du coefficient de partage ?
Le coefficient de
partage est d'autant plus grand que le composé organique est plus
hydrophobe, plus soluble dans l'octan-1-ol, alcool à longue
chaîne carbonée.
Les tissus adipeux contiennent des graisses, molécules hydrophobes.
Les molécules organiques hydrophobes ont donc un coefficient de partage
et un FCB élevés.
Etude
du coefficient de partage du pentachlorophénol (PCP)
Le PCP présente des propriétés fongicides utiisées dans la protection
des bois. On les retrouve donc fréquemment dans les résidus
industriels. Une étude complète a été menée par des chercheurs
de l'Institut national de Recherche sur l'Eau du Canada, de la
manière suivante :
on prépare
des mélanges de 4 types ( A, B, C, D) en PCP, eau et octan-1-ol. Pour
chaque mélange on ajuste le pH de la phase à l'une des 16
valeurs choisies entre 1,2 et 13,5. On obtient donc 4*16 = 64
mélanges différents, que l'on soumet chacun aux opérations ci-après.
Après 1 h 30 de centrifugation du mélange, on laisse reposer le
système pendant 12 h. On sépare ensuite les deux phases. A la phase
aqueuse on ajoute1,0 g de soude NaOH solide et, après
dissolution,1,5 mL d'anhydride acétique et 5 mL de toluène. Après
réaction sous agitation pendant 1 h 15, on récupère la phase organique
que l'on analyse par chromatographie en phase gaz.
mélange
|
A
|
B
|
C
|
D
|
masse
de PCP en mg
|
0,02
|
0,1
|
0,2
|
1,0
|
volume
d'octan-1-ol ( mL)
|
2
|
10
|
2
|
10
|
volume
d'eau ( mL)
|
200
|
200
|
200
|
200
|
Donner la formule
semi-développée du pentachlorure de phénol ( que l'on pourra
noté ArOH).
Le PCP est un acide faible de pKa = 4,8.
Le phénol est un acide de pKa = 9,9.
Comment expliquer
cette différentce d'acidité ?
L'élément chlore est
attracteur d'électron par effet inductif : les 5 atomes de chlore
diminuent donc la densité électronique du noyau benzénique par effet
inductif.
La polarité de la liaison O-H
est plus grande, l'hydrogène est donc moins lié à l'oxygène ;
l'hydrogène est plus libre.
L'acide ArOH est
donc plus fort ( pKa du couple acide / base plus faible ) que le
phénol PhOH.
En conséquence la base
ArO- est moins stabilisée que la base ion phénolate PhO-.
La base ArO- est
plus faible que la base
PhO-.
L'effet inductif compense la charge négative de la base RO-
qui est alors plus stable ; l'équilibre de dissociation de l'acide est
déplacé vers la droite :
AH + H2O = A- + H+, l'acide AH
est plus fort.
Dans le cas
du mélange A, à pH=1,2, on trouve une valeur de log POW
égale à 4,74.
En
déduire les concentrations en PCP dans chacune des phases.
Pourquoi le volume d'eau est-il beaucoup plus grand que celui
d'octan-1-ol ?
MPCP
=5*35,5 + 6*12 + 16 +1 = 266,5 g/mol ;
Quantité de matière initiale n = m / MPCP
=2 10-5 / 266,5 =7,50 10-8 mol.
La conservation du PCP s'écrit : [X]octanol
Voctanol
+ [X]eau
Veau = n ; 0,002
[X]octanol
+ 0,2 [X]eau =7,50 10-8.
POW = 104,74
=5,495 104 ;
POW = [X]octanol / [X]eau.
[X]octanol
= POW
[X]eau =5,495
104 [X]eau.
0,002 *5,495 104
[X]eau
+ 0,2 [X]eau
=7,50
10-8.
[X]eau
=6,80 10-10 mol/L.
[X]octanol
= 5,495 104 [X]eau
= 5,495 104 *6,80
10-10 =3,74 10-5 mol/L.
Le PCP est très soluble dans l'actan-1-ol et peu soluble dans l'eau. Il
faut donc prendre un grand volume d'eau afin de retrouver dans
l'octan-1-ol une quantité notable de PCP.
En partant d'un faible volume d'eau, le PCP présent dans
l'octan-1-ol serait difficile à déceler.
La
courbe suivante montre l'évolution du coefficient de partage avec le pH
de la phase aqueuse.
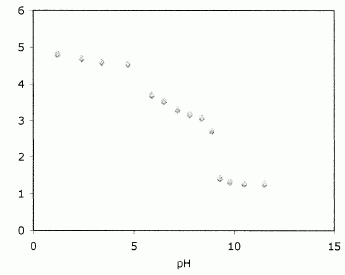
Commenter
la décroissance nette observée autour de pH =5.
A pH inférieur à pKa ( 4,8) la forme acide ArOH du PCP prédomine ; à pH
> pKa la forme base ArO- du PCP prédomine : un composé
ionique est plus soluble dans l'eau que dans l'octan-1-ol.
Les solutions à pH élevé sont riches en soude.
Proposer
une explication à la deuxième phase de décroissance observée vers pH=9.
Complexation de la base ArO- par les ions sodium Na+
: la concentration de ces derniers augmente.
Le complexe est plus soluble dans l'eau que la base ArO-.
Un élève de première scientifique vous
présente cette publication comme base de travail pour l'épreuve de TPE :
comment
lui
expliquer les différentes opérations mises en jeu de la centrifugation
à l'analyse, en faisant référence à ses connaissances en chimie
?
Après
1 h 30 de "centrifugation du
mélange" :
on oblige les deux liquides non miscibles à se mélanger afin que
la plus grande partie du PCP passe dans la phase organique
on laisse "reposer le système
pendant 12 h ":
on réalise une décantation ; les phases se séparent.
On sépare ensuite
les deux phases.
Cela est analogue à l'extraction par solvants.
A la phase aqueuse on
ajoute1,0 g de soude NaOH solide
et, après dissolution,1,5 mL
d'anhydride acétique
On réalise une estérification entre ArOH et l'anhydride acétique : dans
ce cas la réaction est totale.
et 5 mL de toluène.
Il s'agit d'une nouvelle extraction par solvant : l'ester est plus
soluble dans le toluène que dans l'eau.
l'on analyse par chromatographie en phase gaz.
Il s'agit d'une
technique de séparation et d'identification d'une substance comme la
chromatographie sur couche mince.
|
|
Un étudiant de
deuxième année de classes préparatoires présente dans un TIP les
résultats de cette publication.
Proposer 4
questions à lui poser afin de vérifier qu'il a bien compris ces
différentes opérations et qu'il a un regard critique sur ce procédé.
Q1
: décrire l'action de la soude sur le PCP et la réaction qui se produit
avec l'anhydride ?
R : on forme un nucléophile, l'ion RO- ; ce
dernier réagit avec un centre électrophile de l'anhydride pour
conduire à un ester.
Q2
: quelle est l'utilité du toluène ?
R : extraction par solvant
Q3
: comment déterminer la concentration du PCP dans l'eau après
centrifugation ?
R : il faut connaître le rendement de l'estérification ainsi que
le coefficient de partage de l'ester entre le toluène et l'eau.
Q4
: la phase aqueuse peut-elle être analyser directement ?
Non, car PCP
existe sous plusieurs formes selon le pH de la phase aqueuse.
En réalité ces 64 déterminations ont été réalisées deux fois chacune.
Pour chaque valeur de pH, on a donc déterminé 8 valeurs de log POW,
dont on fait une moyenne.
Définir la justesse
( ou précision ) d'une méthode expérimentale. Quelle grandeur permet de
l'évaluer ?
Les mesures sont reproductibles et les valeurs obtenues ne s'écartent
pas trop de la valeur moyenne.
On calcule l'écart type
Définir
l'exactitude d'une mesure expérimentale. Que fait-on calculer aux
élèves pour l'évaluer ?
La valeur expérimentale doit être aussi proche que possible de la
valeur théorique.
On calcule l'écart relatif.
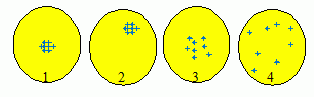
Pour faire comprendre aux élèves la différence entre ces deux notions,
on peut représenter les huit résultats par des points d'impact sur une
cible, centrée sur la valeur attendue pour la grandeur mesurée. On
distingue alors les 4 cas suivants :
1. bone justesse et bonne exactitude
2. bonne justesse et mauvaise exactitude
3. mauvaise justesse et bonne exactitude
4. mauvaise justesse et mauvaise exactitude.
Représenter ces 4
cibles.
|
.
|
|