|
|
Généralités.
Quel savant, et à quelle époque, a conçu le première générateur électrochimique ? Quelle en était la conception ?
Le physicien italien Volta réalise en 1800 la première pile
électrochimique en empilant des disques de cuivre et de zinc, séparés
par des tissus imprégnés d'une saumure.
Les élèves peuvent être tentés d'assimiler cette pile à la pile Daniell.
Quels
sont les couples mis en jeu dans chacune de ces deux piles ? Quelles
analogies et différences peut-on proposer entre cette première pile et
les générateurs électrochimiques qui figurent dans leurs cours ?
Pile Daniell : le zinc réducteur s'oxyde en ion zinc (II) : couple Zn2+aq / Zn(s). Le zinc constitue l'anode.
Les ions cuivre (II) sont réduits en cuivre : couple Cu2+aq / Cu(s).
Pile de Volta : le zinc réducteur s'oxyde en ion zinc (II) : couple Zn2+aq / Zn(s). Le zinc constitue l'anode.
L'eau est réduite sur l'électrode de cuivre ( électrode inerte) : couple H2O (liq) / H2(g).
En lycée seules les piles constituées à partir de couples Mn+aq /M s) sont étudiées.
Qu'est ce qui différencie une pile Leclanché d'une pile alcaline ?
Pile Leclanché : l'électrolyte est acide, le chlorure d'ammonium et l'anode est une lame de zinc.
Pile alcaline : l'électrolyte est basique et l'anode est constituée par de la poudre de zinc.
Comment explique t-on les fuites observées sur les piles bâtons ?
Les ions zinc(II) forment en milieu basique des oxydes solides : la carcasse de la pile peut alors gonfler et se fissurer.
Quelques aspects d'un procédé de valorisation des piles usagées.
Les principales étapes d'un procédé de traitement des piles usagées par la société française RECUPYL SA sont les suivantes :
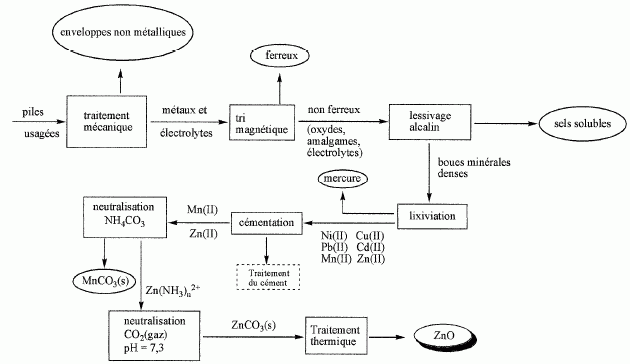
|
|
Etude de la lixiviation.
La lixiviation est une technique d'extraction de produits solubles.
Le
résidu de lessivage comporte des hydroxydes métalliques ainsi que des
particules métalliques fines. La lixiviation est réalisée au moyen
d'acide sulfurique concentré à pH proche de 1.
On donne le diagramme E-pH de l'élément zinc pour une concentration totale en solution c = 10-3 mol/L.
Identifier les domaines de prédominance ou existence des espèces concernées : Zn(s), Zn2+aq, Zn(OH)2 (s) et Zn(OH)42-aq.
|
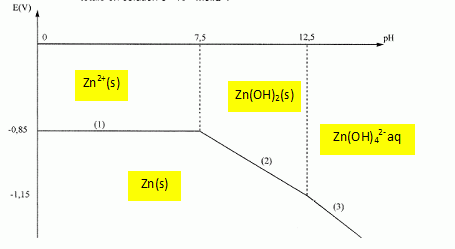
Retrouver le potentiel standard du couple Zn2+aq / Zn(s) ainsi que la pente du segment (3).
La droite 1 est la frontière entre Zn(s) et Zn2+aq : Zn2+aq + 2e- = Zn(s).
E1 = E1°( Zn2+aq /Zn(s)) + 0,03 log [Zn2+aq]
Lecture graphe E1 = -0,85 V et on donne [Zn2+aq] = 10-3 mol/L ;
E1°( Zn2+aq /Zn(s)) = -0,85 -0,03 log10-3 = -0,85 +0,09 = -0,76 V.
La droite 3 est la frontière entre Zn(s) et Zn(OH)42-aq :
Zn(OH)42-aq + 2e- = Zn(s) +4 HO-aq.
E3 = E3°( Zn(OH)42-aq /Zn(s)) + 0,03 log ([Zn(OH)42-aq] / [HO-aq]4) avec [HO-aq] = Ke / [H3O+aq]
E3 = E3°( Zn(OH)42-aq /Zn(s)) - 0,12 log Ke + 0,03 log([Zn(OH)42-aq] +0,012 log [H3O+aq]
E3 = E3°( Zn(OH)42-aq /Zn(s)) - 0,12 log Ke + 0,03 log([Zn(OH)42-aq] -0,012 pH.
La pente de la droite 3 vaut -0,12 V par unité de pH.
A quel condition sur le pH du lessivage alcalin n'élimine t-on pas l'élément zinc au degré II ?
Entre pH = 7,5 et pH = 12,5, l'élément zinc est sous forme d'un hydroxyde solide.
Le pH du lessivage alcalin doit donc appartenir à cet intervalle.
Quelles sont les deux réactions qui se produisent lors de la lixiviation acide des boues contenant entre autres Zn et Zn(OH)2 ?
Dissolution du solide Zn(OH)2 selon une réaction acide base :
Zn(OH)2 (s)+ 2H+aq = Zn2+aq + 2H2O(liq)
Oxydation du zinc métallique en milieu acide :
couples Ox / red : ( Zn2+aq / Zn(s)) et H2O(liq) / H2(g)
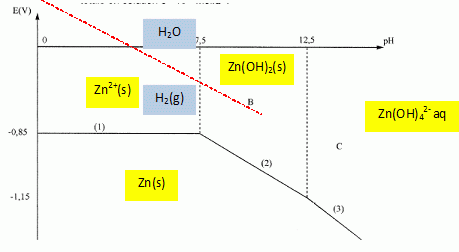
Zn(s) et H2O(liq) appartiennent à deux domaines disjoints, en conséquence :
Zn(s) + 2H+aq = Zn2+aq + H2(g)
|
|
Cémentation.
Définir ce terme.
D'après
le schéma ci-dessus, la cémentation consiste à réduire les ions
Ni(II), Pb(II), Cd(II) et Cu(II) à l'état de métaux solides. Ces
solides métalliques constituent le cément à traiter.
Quel réactif sera t-il judicieux de choisir pour cette étape ? Pourquoi le choisir sous forme de poudre ?
On peut choisir les métaux Zn ou Mn, tous deux de bons réducteurs.
Mais E°(Mn2+aq / Mn(s) = -1,15 V tandis que E°(Zn2+aq
/ Zn(s) ) = -0,76 V : en utilisant le manganèse, on va réduire les ions
zinc à l'état de métal : or le schéma indique que les ions
zinc(II) ne doivent pas être réduits.
Le zinc sera le réducteur utilisé.
En l'utilisant sous forme de poudre, la surface
de contact entre les réactifs est grande : la vitesse de la réaction
sera importante.
Qu'est ce que le cément ? Que contient-il ici ?
Le cément est le dépot métallique solide contenant les métaux Pb, Cd, Ni et Cu.
Quelle expérience spectaculaire peut-on montrer aux élèves en relation avec ce procédé ?
Décoloration d'une solution de sulfate de cuivre par l'addition de zinc en poudre.
|
.
|
|