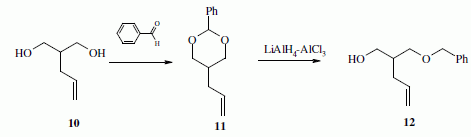|
chimie organique : RMN, énantiomères, diastéréoisomères, acétal, concours chimie agrégation 2008. |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
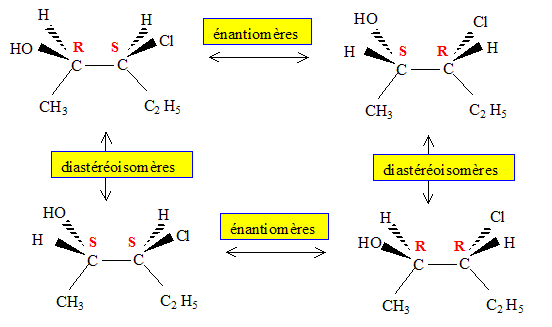
Définir chiralité, énantiomérie, diastéréoisomérie. Chiralité : désigne la propriété d'un objet de ne pas être superposable à son image dans un miroir ( ou dans une symétrie par rapport à un plan). Une main n'est pas superposable à son image dans un miroir. Une molécule comptant un atome de carbone asymétrique est chirale Deux énantiomères ne différent que par leur propriétés optiques ; ils sont séparables. Ce sont 2 isomères de configuration, images l'un de l'autre dans un miroir. « diastéréoisomères » : encore stéréoisomères qui ne sont pas des énantiomères. Des isoméres cis- et trans- (ou Z et E) sont des diastéréoisomères.
Illustration expérimentale mettant en évidence les propriétés différentes de deux énantiomères. - Cas de la deltaméthrine :l'un des énantiomère a des propriétés insecticides, l'autre n'en possède pas. - Les deux énantiomères du citronellal donnent les arômes de citron et d'orange. Le non dédoublement d'énantiomères dans un médicament a eu des conséquences dramatiques dans les années 1960 : les deux énantiomères de la molécule active ont un effet sédatif, mais l'énantiomère (S) a en plus un effet tératogène. Rappeler le nom de ce médicament et la signification du mot tératogène. La thalidomide ; issu du grec, le terme tératogène signifie « création de monstres ». Le mot "racémique" vient du latin racemus qui signifie grappe de raisin. Le premier dédoublement d'un mélange racémique a été réalisé par Pasteur. Comment a t-il réalisé cette séparation ? Quel est le rapport avec la grappe de raisin ? Situer l'époque de cette séparation. Vers 1860, Pasteur sépare manuellement avec une petite pince
des cristaux d'acide tartrique énantiomères. L'acide tartrique était
issu du jus de raisin. La monensine possède des propriétés antibiotiques
intéressantes pour lutter contre les infections coccidiennes ( maladies
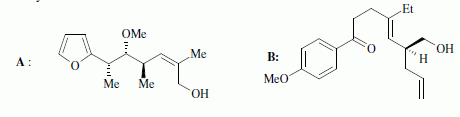
du bétail ). Nous étidions ici partiellement la synthèse de deux
fragments A et B nécessaires à la synthèse totale de la
monensine, qui fut réalisée en 1979 par Y Kishi.
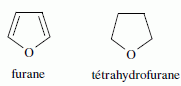
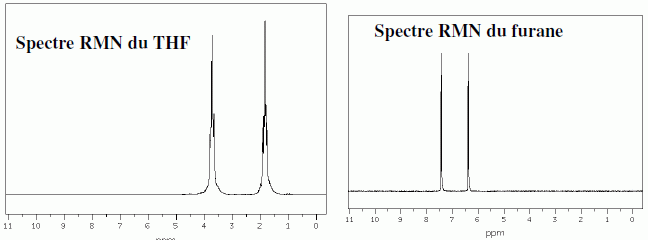
Pour le furane, comme pour le THF, les protons les plus déblindés sont situés en position a de l'atome d'oxygène. Deux isomères I1 et I2 du THF ont des spectres caractérisés par les signaux ci-dessous. 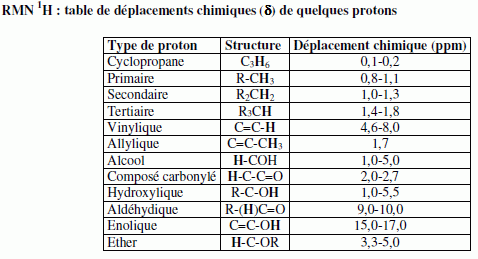 Identifier I1 et I2.
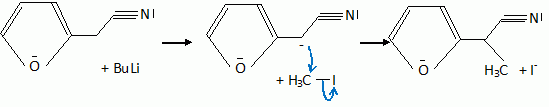
Quelques aspects de la synthèse de A. Le 2-furilacétonitrile 1 est traité par du butyllithium ( Buli) dans le tétrahydrofurane ( THF), puis est opposé à l'iodure de méthyle MeI : on obtient le composé 2. Celui-ci est ensuite chauffé à reflux dans un solvant méthanol-eau pour obtenir le produit 3. 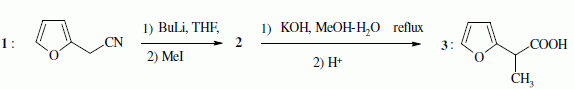 Le composé 1 possède un hydrogène légèrement acide : justifier en écrivant les formes mésomères de la base conjuguée. 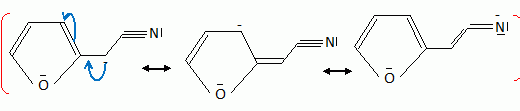 Proposer un schéma réactionnel pour
le passage de 1 à 2. Hydrolyse de la fonction nitrile -CN en acide carboxylique. Le composé 3 possède un atome de carbone asymétrique : obtient-on les deux énantiomères ? Justifier. Dans l'étape 1-->2, le carbanion ne possède pas une configuration particulière : la réaction 1 --> 2 n'est pas stéréosélective : le mélange racémique est donc obtenu. La suite de la synthèse est réalisée avec un seul des deux énantiomères, 3' : 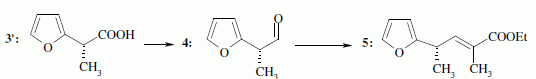 Donner la configuration absolue de l'atome de carbone asymétrique de 3' en justifiant. Numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. (1) -COOH ; (2) cycle ; (3) CH3 ; (4) H. On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S). 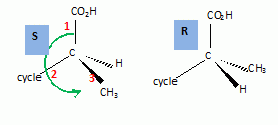 L'atome de carbone asymétrique
est donc R. L'atome de carbone asymétrique
est donc R.Le passage de 4 à 5 est une réaction de Wittig : quel est le réactif utilisé pour réaliser cette transformation ? Les ylures de phosphore sont p dans la réaction de Wittig : ils réagissent sur des carbonyles ( aldehyde ou cétone ) pour conduire à des dérivés éthylèniques. 
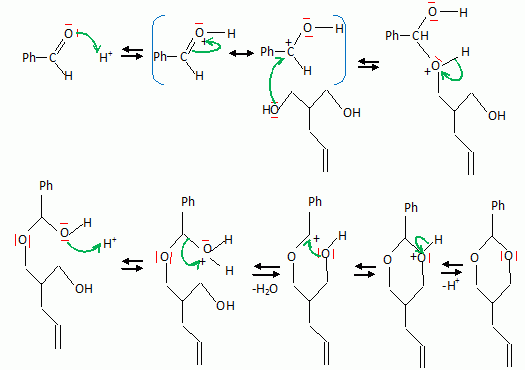
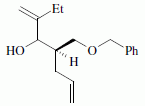
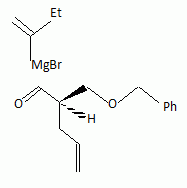
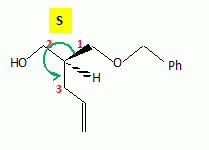
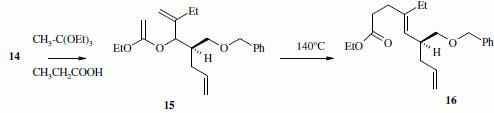
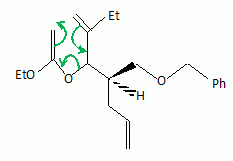
La suite de la synthèse se déroule comme suit :
|
|||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||
|
|