Cette
partie va traiter de l'apport de la chimie pour l'obtention des
matériaux nécessaires au développement des cellules photovoltaïques.
Le
silicium semi-conducteur.
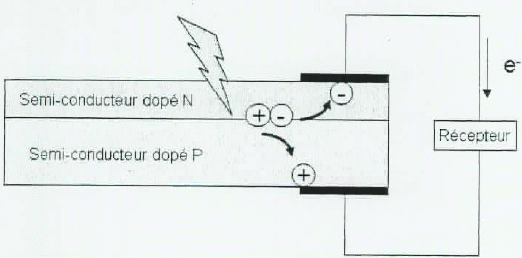
Les cellules photovoltaïques à base de silicium sont obtenues en créant
une jonction P-N entre des semi-conducteurs de type P( défaut
d'électrons) et N ( excès d'électrons ). Sous l'action de la lumière,
il y a formation d'une paire électron-trou et l'action du champ
électrique créé par la jonction P-N permet la séparation des charges.
Le courant électrique résulte de la migration des charges chacune de
leur côté.
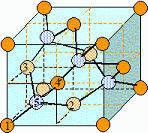
Le silicium cristallise dans une structure de type diamant.
Décrire cette
structure à l'aide d'un schéma.
La structure de type diamant est une maille cubique à
face centrée avec occupation de la moitié des sites tétraèdriques ( 4
sur 8) de façon alternée, ce qui donne finalement 8 atomes par maille
élémentaire.
Le paramètre de la maille a est égal à 543 pm.
Calculer la densité du silicium.
Volume d'une maille V= a3 =( 543
10-12)3 =1,60 10-28
m3.
masse de 8 atome de silicium : 8*28,1 10-3
/ 6,02 1023 = 3,73 10-25 kg
masse volumique : 3,73 10-25 / 1,60
10-28 = 2,33 103 kg
m-3 = 2,33 g cm-3 : d = 2,33.
Indiquer
à quoi correspond la bande de valence, la bande de conduction et la
bande interdite dans la théorie des bandes pour un semi-conducteur
comme le silicium.
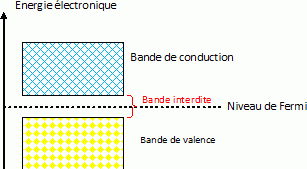
Les valeurs de l'énergie d'un électron dans un solide sont comprises
dans certains intervalles que l'on nomme « bandes permises», séparés par d'autres « bandes d'énergie interdites».
Le silicium peut être dopé P ou N en faisant diffuser du gaz phosphine ( PH3) ou diborane ( B2H6) dans du silicium fondu.
Indiquer à quoi correspond le dopage du silicium et quel type de dopage sera obtenu en fonction du gaz utilisé.
On remplace un petit nombre d'atome de silicium par des atomes
"impuretés" de phosphore ou de bore dans le but de modifier la
conductivité du semi-conducteur.
Si l'atome impureté appartient à la colonne précédente ( cas du bore) ,
il manque un électron ; cette carence en électron, c'est à dire
présence d'un trou, conduit au dopage P.
Si l'atome apporté appartient à la colonne suivante ( cas du phosphore ), un électron est excédentaire. Il s'agit d'un dopage N.
|
Préciser en quoi correspond la formation d'une paire électron-trou sous l'action d'un rayon lumineux.
Un rayon lumineux peut apporter suffisamment d'énergie pour qu'un
électron de la bande de valence soit excité et passe dans la bande de
conduction. Ce départ de l'électron laisse une place vide ( un trou )
dans la bande de valence.
Déterminer
la valeur limite de la longueur d'onde du rayon lumineux pour que soit
créée une paire électron-trou si la bande interdite est de 1,1 eV.
E = hc/l ; l = hc/E = 6,02 10-34 *3,0 108 / (1,1*1,6 10-19) =1,026 10-6 m ~1,0 µm.
|
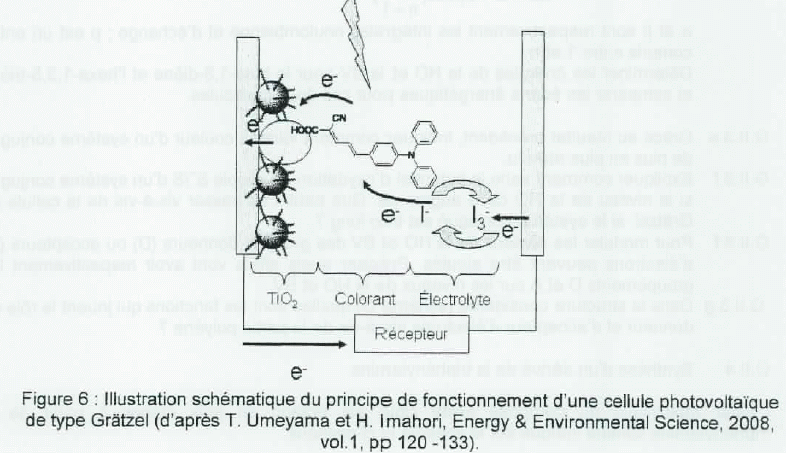
Les cellules de type Grätzel.
Elles sont inspirées de la photosynthèse et dissocient l'absorption de
la lumière et la séparation des charges. La cellule est composée d'un
semi-conducteur à large bande interdite tel que le dioxyde de
titane TiO2 ( DE=3,2
eV) recouvert d'un colorant organique sous forme d'une couche
monomoléculaire et d'un électrolyte contenant des ions iodure. Le
colorant absorbe la lumière en donnant un état excité noté S* et éjecte
un électron dans la bande de conduction de TiO2, en donnant un état S+. Les ions iodures sont oxydés par S+. Les ions triodure I3- formés migrent vers la cathode où ils sont réduits par les électrons provenant de la photo-anode lorsque la pile débite.
Indiquer
brièvement à quoi correspond la photosynthèse effectuée par les
plantes. Ecrire l'équation de la réaction généralement admise.
Les plantes synthétisent de la matière organique en utilisant l'énergie du soleil, du dioxyde de carbone et de l'eau.
6 CO2 + 6 H2O + lumière = C6H12O6 + 6O2 .
Décomposer
chacune des étapes décrites dans la figure ci-dessus en écrivant les
équations des différentes réactions redox qui interviennent.
Les ions iodures sont oxydés par S+ : 3I- = I3- +2 e- ;
Les ions triodure I3- formés migrent vers la cathode où ils sont réduits par les électrons provenant de la photo-anode : I3- +2 e- = 3I-.
Approche théorique de la synthèse des colorants.
Des
dérivés de la triphénylamine ( schéma ci-dessous ) qui comportent une
partie linéaire conjuguée ont été récemment utilisés comme colorant
dans les cellules de type Grätzel.
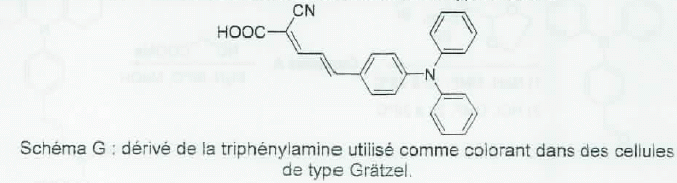
Pour que le système fonctionne il faut que les énergies des
niveaux HO et BV du colorant soient respectivement plus bas que le
niveau imposé par le couple I3- / I- et plus élevé que le niveau de fermi de TiO2.
Les niveaux de la HO et BV pour la partie linéaire conjuguée
peuvent être prédits par une approche théorique telle que la théorie de
Hückel.
Donner la définition d'un système conjugué linéaire.
Système présentant une alternance de liaisons carbone simples (σ) et liaisons doubles (σ+π).
Dans un système conjugué on peut écrire plusieurs formes limites de la molécule : les électrons p, les doublets non liants sont délocalisés sur plusieurs centres. La molécule est stabilisée.
A quoi correspondent les niveaux HO et BV.
HO : plus haute orbitale occupée ; BV : plus basse orbitale vacante.
Préciser les approximations faites dans la méthode de Hückel.
Le squelette de la molécule plane est constitué d'orbitales moléculaires s ( recouvrement axial d'orbitale atomique s ou p). Le recouvrement latéral des orbitales atomique pz constitue les orbitales moléculaires p.
Les systèmes s et p sont indépendants et orthogonaux dans la théorie de Hückel.
De plus pour des atomes identiques les intégrales coulombiennes
sont égales : elles sont notée ß pour des atomes liés et valent zéro si
les atomes ne sont pas liés.
Enfin les intégrales de recouvrement Srs valent 0 si r diffère de s et Srr = 1.
Pour un polyène linéaire à n atomes de carbone, les énergies
des orbitales moléculaires sont données dans le modèle de Hückel par la
relation : Ep = a +2ß cos [p p / (n+1)]
où a et ß sont respectivement les intégrales coulombienne et d'échange ; p est un nombre entier compris entre 1 et n.
Déterminer les
énergies de la HO et de la BV pour le buta-1,3-diène et
l'hexa-1,3,5-triène et comparer les écarts énergétiques pour ces deux
molécules.
Buta-1,3-diène : n=4 ; E1 = a+2ß cos (p/5) = a+1,618 ß.
E2 = a+2ß cos (2p/5) = a+0,618 ß. HO.
E3 = a+2ß cos (3p/5) = a-0,618 ß. BV.
Ecart entre la HO et la BV : 2*0,618 ß = 1,236 ß.
Hexa-1,3,5-triène : n=6 ; E1 = a+2ß cos (p/7) = a+1,80 ß.
E2 = a+2ß cos (2p/7) = a+1,247 ß.
E3 = a+2ß cos (3p/7) = a+0,445 ß. HO.
E4 = a+2ß cos (4p/7) = a-0,445 ß. BV.
Ecart entre la HO et la BV : 2*0,445 ß = 0,89 ß.
Indiquer comment varie la couleur d'un système conjugué de plus en plus étendu.
L'écart énergétique est plus faible dans le cas de l'hexa-1,3,5-triène par rapport au buta-1,3-diène.
Cette transition doit donc nécessiter un photon d'énergie moins élevée
que dans le buta-1,3-diène ; donc de longueur d'onde plus grande. On
passe de 270 nm pour l'hexa-1,3,5-triène au spectre visible pour une
dizaine de doubles liaisons conjuguées.
Expliquer comment varie le potentiel d'oxydation du couple S+/S
d'un système conjugué si le niveau de la HO de S augmente. Que peut-il
se passer vis à vis de la cellule de Grätzel si le système conjugué est
trop long ?
La conjugaison rapproche les orbitales frontières HO et BV. Le potentiel d'oxydation du couple S+/S va donc diminuer si la longueur du système conjugué augmente ; en conséquence les ions iodures ne seront plus oxydés par S+si le système conjugué est trop long.
Pour moduler les niveaux de la HO et BV des groupes donneurs (D) ou accepteur (A) d'électrons peuvent être ajoutés.
Préciser quels effets vont avoir respectivement les groupes pements D et A sur les niveaux de la HO et de la BV.
Un
substituant donneur relève plus la HO que la BV, tandis qu'un accepteur
abaisse la BV plus que la HO : le rapprochement HO-BV est encore
accentué.
Les groupes attracteurs CN, COOH, CHO, NO2 augmentent le potentiel d'oxydation. Les groupes donneurs diminuent le potentiel d'oxydation.
Synthèse d'un dérivé de la triphénylamine.
L'ester méthylique du composé acide cible est obtenu en trois étapes à partir de la triphénylamine comme indiqué ci-dessous :
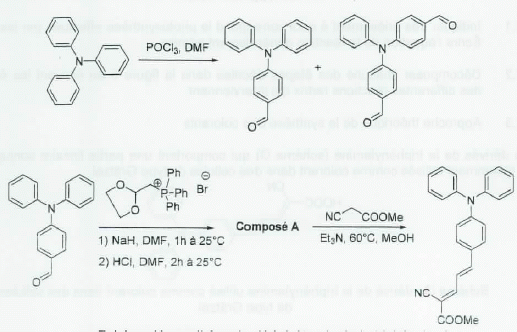
La
première étape est une réaction de Vilsmeier-haack conduisant à un
mélange de deux produits qui sont séparés par une chromatographie sur
colonne avec du gel de silice comme phase stationnaire et un mélange
d'acétate d'éthyle et de cyclohexane comme éluant. Une étude par
chromatographie sur couche mince ( CCM) montre quen utilisant un
mélange de 10 mL de cyclohexane avec 2 mL d'acétate d'éthyle, les
rapports frontaux( Rf) des deux composés sont respectivement 0,7 et 0,3
pour le mono et dialdehyde.
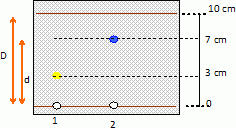
Proposer un protocole détaillé permettant de réaliser une CCM.
Cette CCM
doit permettre de comparer le produit récupéré à l'issue d'une synthèse
au même produit acheté dans le commerce. On expliquera soigneusement :
la préparation de la cuve, la préparation de la plaque, l'élution, la
révélation, la mesure des rapports frontaux.
Préparation de la plaque :
Tracer au crayon à papier une ligne à un
peu plus de 1 cm du bas de la plaque . Marquer au crayon sur
cette ligne les emplacements où l'on déposera
les solutions à analyser. Les emplacements doivent
être distants d'environ 1 cm, et à au moins 1
cm des bords.
Dépôt de l'échantillon :
A l'aide d'une pipette pasteur, ou d'un tube capillaire,
déposer une goutte sur la plaque à
l'emplacement marqué. Laisser sécher . Si la
solution est trop diluée, on peut faire plusieurs
dépôts au même emplacement , à
condition de bien sécher la plaque entre deux
gouttes.
Développement du chromatogramme :
Lorsque les dépôts sont secs, placer la
plaque le plus verticalement possible dans la cuve, ligne de
dépôt vers le bas. La surface de
l'éluant doit être en de cette ligne. Couvrir.
Surveiller la plaque régulièrement : quand
l'éluant est à environ 1 cm du bord
supérieur, sortir la plaque, marquer le niveau
atteint par le solvant au crayon à papier,
sécher la plaque.
Révélation :
Si les taches sont incolores, on les fera
apparaître sous une lampe UV ou à l'aide d'un
chimique.

|
1 : espèce pure, étalon ou référence.
2 : espèce pure, étalon ou référence.
3 : produit du commerce
4 : espèce obtenue par synthèse
|
Faire un schéma de la plaque CCM obtenu dans l'expérience ci-dessus.
|
La synthèse du composé A se déroule en deux parties effectuées successivement dans le même réacteur comme décrit ci-dessous :
Un tricol maintenu sous diazote contenant une suspension d'hydrure de
sodium NaH ( 250 mg, 0,01 mol) dans 5 mL de DMF ( diméthylformamide,
solvant ) est refroidie à -5 °C. A l'aide d'une ampoule de coulée
isobare, le sel de phosphonium (4,3 g , 0,01 mol) dissous dans 15 mL de
DMF est additionnée goutte à goutte ; le dégagement gazeux doit être
contrôlé. Après addition on laisse le mélange revenir à température
ambiante, et l'agitation est maintenue 15 min. Le triphénylamine
monoaldehyde ( 2,7 g, 0,01 mol) dissous dans 20 mL de DMF est
additionné avec un goutte à goutte assez rapide et l'agitation est
maintenue pendant 1 h à température ambiante. On ajoute alors
prudemment 10 mL d'une solution d'acide chlorhydrique à 2 mol/L puis à
nouveau 30 mL de la solution acide ; le mélange est maintenu 2 h sous
agitation à température ambiante.
Le composé organique extrait avec de l'éther diéthylique est lavé avec
une solution saturée d'hydrogénocarbonate de sodium puis deux fois à
l'eau. La phase organique est séchée sur sulfate de magnésium anhydre
puis le solvant est évaporé pour donner un solide jaune qui est
recristallisé dans l'éthanol.
Parmi les compétences exigibles du programme de spécialité de terminale S on trouve :
- réaliser les opérations suivantes : lavage d'une phase
organique, séchage d'une phase organique liquide, extraction
liquide-liquide, séchage d'un solide, recristallisation.
- Appliquer les consignes de sécurité.
- Justifier les opérations d'un protocole à partir des données
physico-chimiques ( température de changement d'état, densité, pH,
solubilité ).
Illustrer ces différentes notions en décrivant les opérations citées dans les deux dernières phrases du protocole ci-dessus.
" Le composé organique extrait avec de
l'éther diéthylique est lavé avec une solution saturée
d'hydrogénocarbonate de sodium puis deux fois à l'eau" :
L'ion hydrogénocarbonate se comporte comme une base en milieu acide ; l'excès d'acide est éliminé ( dégagement CO2).
Les deux lavages à l'eau élimine toute trace d'acide.
" Le composé organique
extrait avec de l'éther diéthylique" : séparation de la phase aqueuse (
la plus dense) de la phase éthérée contenant entre autre, le produit
organique de la synthèse. La phase la plus dense occupe la partie basse
de l'ampoule à décanter.
"La phase organique est séchée sur sulfate de magnésium anhydre" : élimination des dernières traces d'eau de la phase organique.
" le solvant est évaporé" : distillation simple, l'éther est très volatil.
" un solide jaune qui est recristallisé dans l'éthanol" : procédé de purification.
Elle permet de séparer le produit des
impuretés en jouant sur la différence de solubilité du produit et des impuretés dans
un solvant. On dissout l'ensemble à chaud dans le volume miminum de solvant,
puis on laisse refroidir. Le produit
cristallise alors que les impuretés doivent rester dans le solvant.
Les impuretés sont solules à chaud comme
à froid dans le solvant ; le produit n'est soluble qu'à chaud dans le
solvant.
Donner la structure du réactif obtenu par addition d'hydrure de sodium sur le sel de phosphonium. Indiquer la nature du dégagement gazeux. Préciser le nom de la réaction effectuée. Donner la formule semi-développée de A.
L'ion hydrure est une base très forte, conjuguée de l'acide H2.
On va donc observer un dégagement de dihydrogène et le réactif obtenu est un ylure de phosphore.
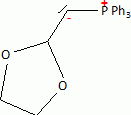
La réaction de Wittig ( l'addition d'un ylure de phosphore sur un composé carbonylé ) donne un composé éthylénique.
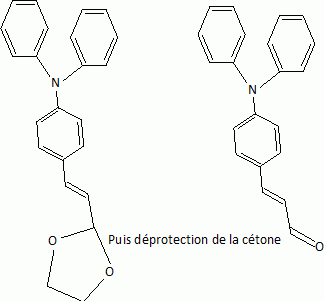
|
|









