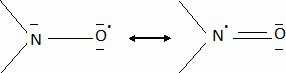Une
pile à combustible permet de convertir directement une énergie chimique
en énergie électrique pour une réaction de combustion.
Rendement théorique d'une pile.
Le rendement d'une pile est donné par le rapport entre l'énergie
électrique récupérée sur la variation d'enthalpie de la tansformation :
r = -We / DH. Le
rendement maximal accessible est calculé en considérant un
fonctionnement réversible avec une tension correspondant à la force
électromotrice théorique e°.
Justifier la présence du terme DH au dénominateur.
Un rendement est égal à l'énergie utile ( dans ce cas l'énergie
électrique récupérée) divisée par l'énergie dépensée ( c'est à dire
l'enthalpie de la transformation).
A pression et température constantes, montrer le lien entre la variation d'enthalpie libres du système et We.
We = n F e° ; DrG° = - nFe° ; DrG° = -We ;
Or DrG° = DrH° -TDrS° ; r = (DrH° -TDrS° ) / DrH° = 1-TDrS° / DrH°.
Evaluer les rendement théoriques pour les piles PEMFC et DMFC.
type de pile
|
électrolyte
|
combustible
|
température
|
rendement
|
PEMFC
|
H+
|
H2
|
60 - 100°C
|
40 - 45 %
|
DMFC
|
H+ |
CH3OH(l)
|
60 - 70 °C
|
40 - 45 %
|
H2+ ½ O2= H2O(l) ;
DrH° = DfH°(H2O(l))- DfH°(H2) -0,5 DfH°(O2)= -286 -0-0 = -286 kJ/mol
DrS° = S°(H2O(l))- S°(H2) -0,5 S°(O2)= 70-130-205/2 = -162,5 J K-1 mol-1.
DrG° = DrH° -TDrS° = -286 000 - (273+60)(-132,5) =-2,32 105 kJ/mol
r = 2,32 105 / 2,86 105 ~0,81. Valeur théorique maximale correspondant à la réversibilité ; le rendement réel est inférieur.
CH3OH(l) + 1,5 O2= CO2 +2H2O(l) ;
DrH° = 2DfH°(H2O(l))+DfH°(CO2) - DfH°(CH3OH) -1,5 DfH°(O2)= -2*286 -393+239 = -726 kJ/mol
DrS° = 2S°(H2O(l))+S°(CO2) - S°(CH3OH) -1,5 S°(O2)= 140+213-127-1,5*205= -81,5 J K-1 mol-1.
DrG° = DrH° -TDrS° = -726 000 - (273+60)(-81,5) =-6,99 105 kJ/mol
r = 6,99 105 / 7,26 105 ~0,96. Valeur théorique maximale correspondant à la réversibilité ; le rendement réel est inférieur.
|
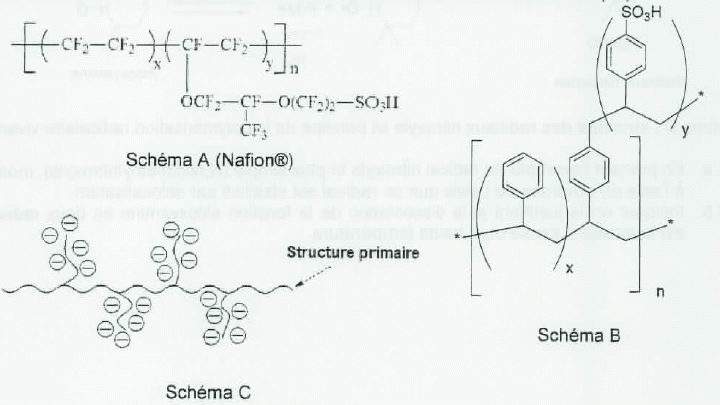
Les membranes des piles PEMFC.
La pile PEMFC fonctionne avec une membrane à polymère échangeuse d'ions
oxonium. Des copolymères à blocs ont été développés telles que le
Nafion( schéma A) ou des structures basées sur des noyaux aromatiques (
schéma B). Les polymères présentent une structure globale correspondant
à une chaîne polymérique primaire sur laquelle sont gréffés des bras
porteurs des fonctions acides ( schéma C représenté sous forme
anionique ).
|
Représenter
la pile en indiquant les équations des réactions aux électrodes ;
indiquer quelles doivent être les propriétés de la membrane séparant
les deux électrodes.
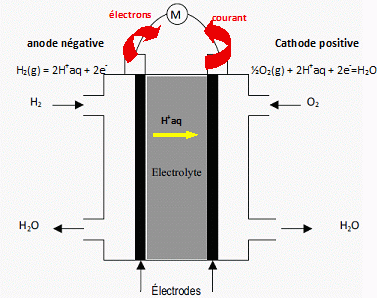
L'électrolyte est une membrane polymère de type acide. Les ions
négatifs sont retenus dans la structure de la membrane alors que seuls
les ions H+ sont mobiles de l'anode vers la cathode.
La membrane doit empécher les gaz ( le dihydrogène qui est très petit, le diazote et le dioxygène) de se mélanger.
Les électrons ne doivent pas être capables de traverser la membrane.
La membrane doit être correctement hydratée ( trop sèche, elle peut se rompre).
Indiquer
pour chacune des structures A et B, la formule du monomère permettant
d'accéder à la structure de base de la chaîne polymèrique primaire.
A : copolymèrisation du tétrafluoroéthylène F2C=CF2.
B : le styrène C6H5-CH=CH2 et le 1,4-divinylbenzène
On
considère la synthèse du copolymère B. Les matières premières pour
obtenir le polymère sont le styrène, l'acide 4-vinylbenzène sulfonique
et le 1,4-divinylbenzène( DVB). La polymérisation se fait suivant un
processus radicalaire en utilisant du peroxodisulfate de potassium K2S2O8 comme initiateur.
En prenant comme monomère le styrène, rappeler le mécanisme simplifié pour une polymérisation radicalaire.
Amorçage : RO-OR --> 2 RO. ; RO. + FCH=CH2 -->
RO-CH2-CHF. avec F : C6H5-
Propagation : RO-CH2-CHF.+ FCH=CH2 -->RO-CH2-CHF-CH2-CHF.
Terminaison : RO. + RO. =RO-OR par exemple ou toutes réactions de couplage entre deux radicaux.
Expliquer pourquoi cette polymérisation ne correspond pas à un mécanisme de polymérisation dite vivante.
Dans une polymérisation dite vivante, il n'y a pas de réaction de
terminaison ; les chaînes de polymères s'accroissent tant qu'il y a des
molécules de monomères.
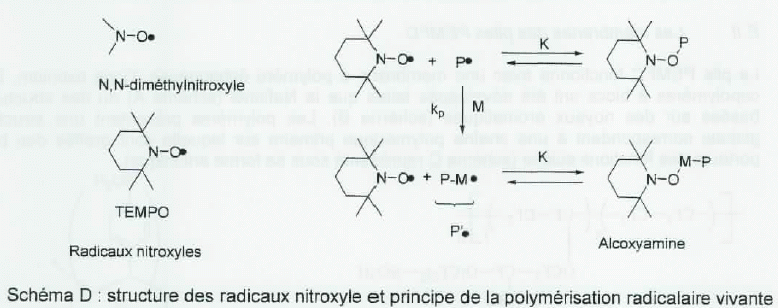
Polymérisation radicalaire vivante.
L'obtention
de la structure recherchée pour le polymère n'est possible que si la
polymérisation est parfaitement contrôlée. Pour cela, une
polymérisation radicalaire vivante peut être obtenue par addition dans
le milieu de radicaux nitroxyle ; ceux-ci ont la particularité de
terminer réversiblement la croissance des centres actifs radicalaires P.
en formant une alcoxyamine appelée espèce dormante ( schéma D
ci-dessous ). En augmentant la température, l'espèce dormante peut
régénérer le radical P. qui en présence de monomère M conduit à l'augmentation de la chaîne polymérique.
Le radical nitroxyle le plus utilisé est le TEMPO (2,2,6,6-tétraméthyl-1-pipéridinloxy ).
En prenant l'exemple du radical nitroxyle le plus simple ( N,N-diméthylnitroxyle), montrer à l'aide de schéma de lewis que ce radical est stabilisé par délocalisation.
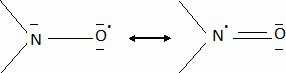
La charge est répartie sur l'atome d'azote et l'atome d'oxygène.
Indiquer
en le justifiant si la dissociation de la fonction alcoxyamine en deux
radicaux est favorisée à basse ou haute température.
L'alcoxyamine, espèce dormante, donne deux radicaux lors d'une
élévation de température, la liaison O-P ou O-MP étant de faible
énergie.
Synthèse du copolymère.
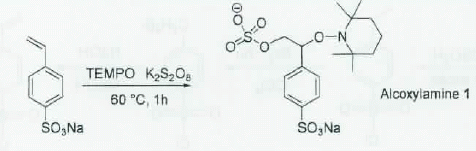
Ecrire le mécanisme de la formation de l'alcoxylamine 1.
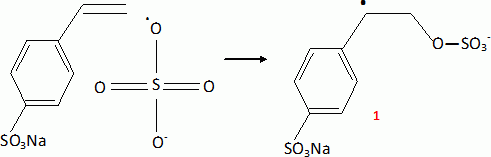
Sous l'action de la chaleur, l'ion peroxodisulfate donne des radicaux sulfate SO4..
1 est un radical persistant, stabilisé par résonance ; il réagit avec
un autre radical persistant ( TEMPO ) et donne l'alcoxylamine 1.
La synthèse du copolymère est décrite dans le schéma ci-dessous :
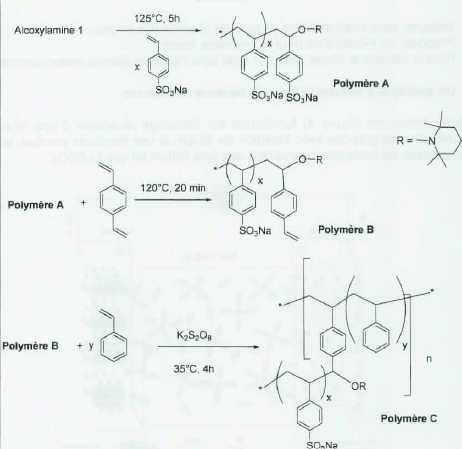
Dans les
trois étapes de polymérisations successives pour obtenir les polymères
A, B et C, quelles sont les polymérisations effectuées selon un
processus de polymérisation radicalaire vivante ?
L'obtention des polymères A et C sont des polymérisations radicalaires vivantes.
Le pasage du polymère A au polymère B est une réaction de transfert qui permettra de réamorcer la chaîne.
Expliquer pourquoi, dans la dernière étape de polymérisation, il faut ajouter du peroxodisulfate de potassium.
Synthèse du 4-vinylsulfonate de sodium.
La synthèse peut être effectuée à partir de l'éthylbenzène en trois étapes selon le schéma ci-dessous :
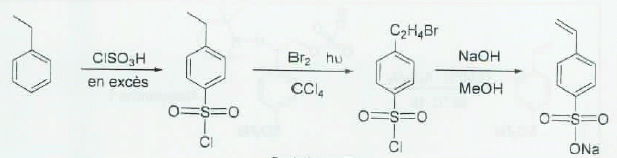
Indiquer pour chaque étape le type de réaction mis en jeu.
Etape 1 : substitution électrophile sur le noyau benzénique.
Etape 2 : substitution radicalaire sur la chaîne latérale.
Etape 3 : élimination de HBr.
Proposer un mécanisme pour la première étape.
L'autoprotonation d'un acide fort conduit à l'électrophile ClSO2+.
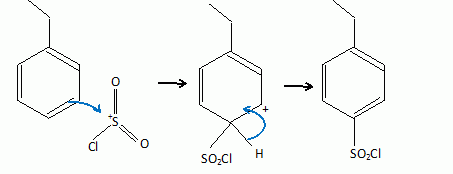
Pour la deuxième étape, préciser quel sera l'isomère obtenu majoritairement.
La bromation est régiosélective ( position benzylique ). Dans l'étape déterminante, un radical benzilique stable se forme.
|
La batterie lithium-ion.
Elle
fonctionne sur l'échange réversible d'ions lithium entre une électrode
négative en graphite avec insertion de lithium et une électrode
positive, le plus souvent un oxyde de métal de transition incorporant
des ions lithium tel que LixCdO2.
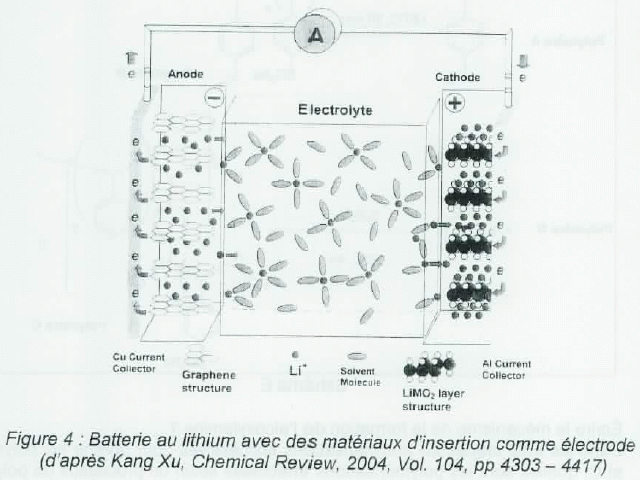
Dans l'électrode positive, les ions lithium sont insérés dans la phase cristalline de l'oxyde de cobalt ( CoO2),
permettant de compenser la charge lors du processus redox au niveau du
cobalt. La structure du matériau est intermédiaire entre les structures
LiCoO2 et CoO2.
Indiquer le nombre d'oxydation du cobalt pour ces deux valeurs limites.
n.o(Co) dans LiCoO2 : 1+n.0(Co) -2*2 = 0 ; n.o(Co) = +III ;
n.o(Co) dans CoO2 : n.0(Co) -2*2 = 0 ; n.o(Co) = +IV.
Ecrire l'équation de la réaction réversible de charge et décharge pour cette électrode.
Li+ + e- = Li.
La structure cristalline de LiCoO2 est décrite comme une structure cubique à faces centrées en anions O2- avec tous les sites octaèdriques occupés pour moitié par les cations lithium et l'autre moitié par les ions cobalt.
Représenter une maille cubique à faces centrées et indiquer la position de tous les sites octaèdriques.
Site octaèdrique :octaèdre. Il y en a
4 par maille ; ils sont
situés au centre de la maille et aussi au milieu des
arètes.
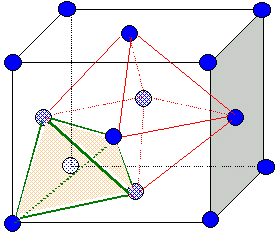
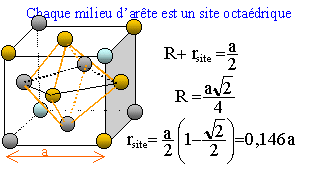
Calculer le rapport minimum r = r+ / r- entre les rayons des cations et des anions.
r+(Li+) = 60 pm ; r+(Co2+) = 74 pm ; r+(Co3+) = 63 pm ; r-(O2-) = 140 pm.
r+ = rsite = 0,146 a = 0,146*2(r++r-) ; r = r+ / r- = 0,41.
r+(Li+) / r-(O2-) =60/140=0,43 ; r+(Co3+) / r-(O2-) =63/140=0,45.
|
|