Pile
zinc-argent.
On considère une pile électrochimique
construite avec les couples Zn2+/Zn et Ag+/Ag.
Décrire deux
expériences simples mettant en évidence la différence entre réaction
chimique et réaction électrochimique.
Au cours d'une réaction chimique des espèces chimiques sont modifiées.
Au cours d'une réaction chimique, certaines liaisons entre atomes sont
créées, d'autres sont rompues.
Exemple : combustion du méthane.
Une réaction électrochimique est une réaction chimique au cours de
laquelle il y a conversion d'énergie électrique en énergie chimique ou
l'inverse ( électrolyse, pile)
Exemple : plonger une lame de
fer dans une solution de sulfate de cuivre : le cuivre se dépose sur le
fer, au bout d'un certain temps la couleur bleue de la solution
disparaît. Une réaction électrochimique se déroule à l'interface fer -
solution avec transfert de un ou plusieurs électrons. La vitesse d'une
réaction électrochimique peut être modifiée en changeant le
potentiel d'une électrode.
Présenter
en
cinq ligne au plus le principe de fonctionnement d'une pile zinc-
argent dans une classe de terminale scientifique, en s'appuyant sur un
schéma.
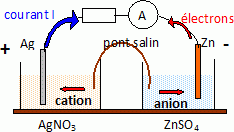
Le zinc, métal plus réducteur que l'argent, s'oxyde à l'anode et libère
des électrons. Il constitue la borne négative de la pile. Zn(s) = Zn2+aq
+ 2e-.
Les ions argent se réduisent à la cathode positive : 2Ag+aq
+ 2e- = 2Ag(s).
Bilan : Zn(s) +2Ag+aq = Zn2+aq + 2Ag(s).
Le pont salin assure la continuité électrique ; il permet d'assurer la
neutralité électrique de chaque solution ( migration des ions ).
Diagramme
potentiel - pH du zinc.
La figure suivante présente le diagramme potentiel - pH simplifié du
zinc qui a été tracé en considérant une concentration en espèce
dissoute c = 1,0 10-2 mol/L.
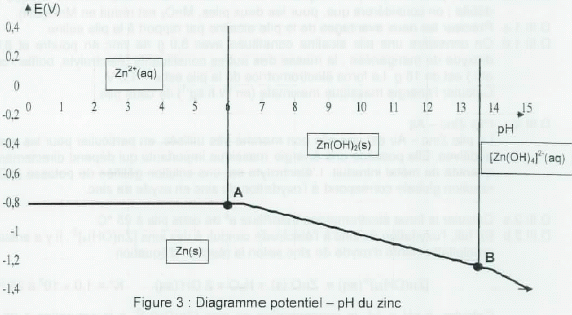
Retrouver
les coordonnées des points A et B et donner l'équation de la droite
reliant ces deux points.
E°(Zn2+/Zn) = -0,76 V ; Constante globale de formation
du complexe [Zn(OH)4]2- : log ß =15 ;
produit de solubilité de l'hydroxyde de zinc Zn(OH)2 à 25 °C
: pKs =17.
Zn(OH)2(s) = [Zn2+] [HO-]2
= 1,0 10-17 avec [Zn2+] = c = 1,0 10-2 mol/L.
[HO-]2 =1,0 10-15
; [HO-] =3,16 10-8 mol/L ; [H3O+]
= 10-14 / [HO-] =3,16 10-7 mol/L ; pH(A) = 6,5.
Zn2+ + 2e- = Zn(s) ; E= E°(Zn2+/Zn)+0,03 log [Zn2+] = -0,76 +0,03 log 0,01 = -0,82 V.
Point B :
Zn2+ + 4HO- = [Zn(OH)4]2- ; ß = 1015
= [[Zn(OH)4]2-] / ( [
Zn2+][HO-]4) ;
Zn(OH)2(s) +2HO-
= [Zn(OH)4]2- ;
K = [[Zn(OH)4]2-] / [HO-]2 = ß[HO-]2
Zn2+] = ßKs =1015* 10-17
= 10-2.
Or [[Zn(OH)4]2-] =c = 10-2 mol/L d'où : 10-2 = 10-2 / [HO-]2 ; [HO-] = 1 ; H3O+]
= 10-14 / [HO-] =10-14 mol/L ; pH(B) = 14.
E= E°(Zn2+/Zn)+0,03 log [Zn2+] avec [Zn2+] = [[Zn(OH)4]2-] / ( ß[HO-]4)
E = -0,76 +0,03 log ([[Zn(OH)4]2-] / ß)-0,12 log[HO-]
E = -0,76 +0,03 log (0,01 / 1015)-0,12*0 = -0,76 -0,51 =-1,27 V.
Segment AB : E =
a pH + b avec a et b des constantes
Au point A : -0,82 = 6,5 a + b ; au point B : -1,27 = 14 a + b ;
a = -0,06 et b = -0,43. E = -0,06
pH -0,43.
Indiquer
les conclusions à tirer de ce diagramme sur la stabilité
thermodynamique du zinc métallique en solution acide ( pH< 2) et en
solution très basique (pH >14).
|
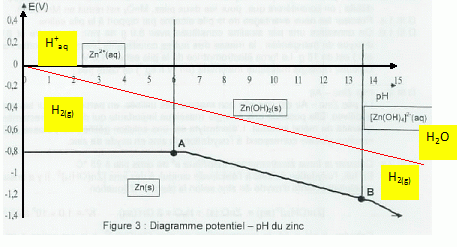
A pH < 2 : Zn(s) et H+aq appartiennent à des domaines
distincts ; le zinc est oxydé en Zn2+aq.
A pH >14 : Zn(s)
et H2O appartiennent à des domaines distincts ; le zinc est
oxydé en [Zn(OH)4]2-. |
Piles commerciales à base de zinc.
|
Pile
saline
|
Pile
alcaline
|
|
|
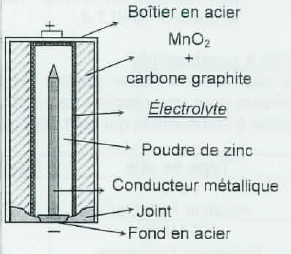
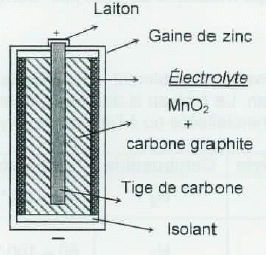
|
anode
|
récipient
de zinc
|
réducteur :
poudre de zinc
collecteur : tige métallique
|
cathode
|
oxydant
: MnO2 + poudre de carbone
collecteur : graphite
|
oxydant
: MnO2 + poudre de carbone
collecteur : récipient en acier. |
électrolyte
|
chlorure
d'ammonium et de zinc gélifiés
|
solution
aqueuse d'hydroxyde de potassium
|
Expliquer pourquoi
dans ces deux types de piles, le dioxyde de manganèse est mélangé à du
carbone.
Le carbone améliore la conductivité
du dioxyde de manganèse.
Ecrire
pour chaque pile, l'équation de la réaction de fonctionnement lorsque
celle-ci débite.
On considèrera que , pour les deux piles, MnO2 est réduit en
MnO(OH).
Saline
: anode : Zn = Zn2+ + 2e- ; cathode : 2MnO2 +
2H+ + 2e-= 2MnO(OH).
Bilan : Zn + 2MnO2 + 2H+ = Zn2+
+2MnO(OH).
Alcaline : anode
: Zn + 2 HO- =
Zn(OH)2 + 2e- ; cathode : 2MnO2 + 2H2O
+ 2e- = 2MnO(OH) + 2HO-
Bilan : Zn + 2MnO2
+ 2H2O = Zn(OH)2 + 2MnO(OH).
Préciser les deux
avantages de la pile alcaline sur la pile saline.
Fonctionne aussi à basse température (jusqu'à -30°C)
Faible résistance interne ; grande densité d'énergie.
Hermétique : la pile alcaline ne peut pas couler.
On
considère une pile alcaline constituée avec 6,0 g de zinc en poudre et
8,0 g de dioxyde de manganèse ; la masse des autres constituants (
électrolyte, boîtier, carbone ... ) est de 18 g. La force
électromotrice de la pile est E = 1,5 V.
Calculer l'énergie massique maximale ( W h kg-1)de cette pile.
Quantité de
matière de zinc : 6,0 / 65,4 =9,17 10-2 mol.
Quantité de matière de dioxyde de manganèse : 8,0 / 86,9 =9,21 10-2
mol.
9,17 10-2 mol réagit avec 2*9,17 10-2 mol de
dioxyde de manganèse. Ce dernier est donc en défaut.
2MnO2 + 2H2O + 2e- = 2MnO(OH) + 2HO-
Quantité de matière d'électrons : n = 9,21 10-2
mol.
Quantité d'électricité : Q = 9,21 10-2 *96500 = 8,89 103
C
Energie disponible : Q E = 8,89 103*1,5 =1,33 104
J = 3,7 Wh
Masse totale de la pile : 32 g ; énergie massique maximale : 3,7 /
0,032 =116 ~1,2 102 W h kg-1.
Pile zinc - air.
La
pile zinc-air est une pile bon marché très utilisée, en
particulier pour les prothèses auditives. Elle possède une
énergie massique importante qui dépend directement de la quantité de
métal introduit. L'électrolyte est une solution gélifiée de potasse (
KOH). La réaction globale correspond à l'oxydation du zinc en oxyde de
zinc.
Calculer
la force électromotrice e0 de cette pile à 25°C.
Zn(s) +½O2(g) = ZnO(s) ; DrH°
= DfH° (ZnO) - DfH°(Zn) -0,5 DfH°(O2)
=-348 kJ/mol.
DrS° =S° (ZnO) - S°(Zn) -0,5 S°(O2)
=44-42-0,5*205=-100,5 J K-1 mol-1.
DrG°= DrH° - T DrS° =-348
000-298*(-100,5) =-3,18 105 kJ/mol.
DrG°= -nFe0
avec n = 2 ; e0 = 3,18 105 /(2*96500) = 1,65 V.
En fait, l'oxydation du zinc à l'électrode conduit à des ions [Zn(OH)4]2-.
Il y a ensuite précipitation lente de l'oxyde de sinc selon la réaction
d'équation :
[Zn(OH)4]2-aq = ZnO(s) +H2O +2HO-aq
K° = 1,0 102 à 25°C.
Calculer à pH=14, la
concentration en ion [Zn(OH)4]2-à la saturation à
25°C en supposant que les coefficients d'activités valent 1 pour les
espèces dissoutes.
K° = 100 =[HO-]2 /[[Zn(OH)4]2-] ; [[Zn(OH)4]2-]= [HO-]2 /100 = 1/100 = 1,0 10-2
mol/L.
La tension de fonctionnement de la pile dépend fortement de la nature
de l'électrode à dioxygène. Cette dernière est en général
constituée de fibre de carbone poreux et d'un catalyseur.
Expliquer
à l'aide de courbes intensité potentiel, comment le catalyseur permet
d'augmenter la tension de fonctionnement de la pile.
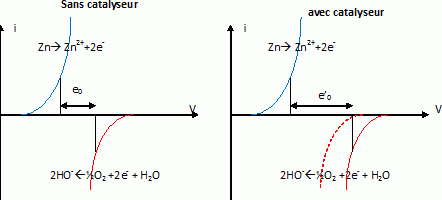
Un
fabriquant propose une pile zinc-air avec une tension moyenne de
fonctionnement U égale à 1,3 V pour laquelle la masse de zinc utile
représente 60% de la masse de la pile.
Calculer
en Wh kg-1 l'énergie massique
de cette pile.
On note m (kg) la masse de la pile ; la masse de zinc est 0,6 m kg =
600 m grammes.
Quantité de matière de zinc : n(Zn) = 600 m / M = 600 m / 65,4 = 9,174
m mol.
Quantité de matière d'électrons n(e-) = 2 n(Zn) = 2*9,174 m
= 18,35 m mol
Quantité d'électricité correspondante : Q = n(e-) F = 18,35
m *96500 = 1,77 106 m C
Energie mise en oeuvre : QU = 1,77 106 m *1,3 = 2,3 106
m J
Energie massique : QU / m = 2,3 106 J kg-1
= 2,3 106 /3600 Wh kg-1 = 6,4 102
Wh kg-1.
Cette valeur est 5 fois plus grande que la valeur correspondante de la
pile alcaline.
|





