Dosage du diester dans un gazole.
Le
diester peut être mélangé avec le gazole avec des teneurs allant
jusqu'à 5 % en masse. Afin de déterminer la teneur en diester dans un
gazole, on effectue le dosage décrit ci-dessous :
On introduit dans un ballon 5,0 mL de gazole, 15 mL d'éthanol puis
exactement 2,5 mL de soude à 1,00 mol/L. Le mélange est chauffé à
reflux pendant 1 heure. Après refroidissement, la solution est dosée
par de l'acide chlorhydrique à 0,100 mol/L en présence de
phénolphtaléine.
Ecrire l'équation de la réaction d'un ester avec la soude.
R-COOR' + Na+ + HO- = RCOO- + Na+ +R'OH.
Préciser le rôle de l'éthanol.
L'éthanol
permet de mettre en contact les réactifs : l'ester est peu soluble dans
l'eau, beaucoup plus dans l'éthanol ; l'ion hydroxyde est soluble dans
l'éthanol, solvant polaire.
Indiquer la nature de la verrerie à utiliser pour prélever le gazole, l'éthanol et la soude.
Les
volumes asez précis, gazole et soude, sont prélevés à l'aide d'une
pipette jaugée. Un volume moins précis, celui du solvant, est mesuré à
l'aide d'une éprouvette graduée.
Quelles consignes doit-on donner au personnel de laboratoire pour la préparation de la solution de soude à 1,00 mol/L ?
Port de blouse, gants et lunettes de protection.
Il faut verser 17,7 mL d'acide chlorhydrique pour atteindre l'équivalence.
Calculer la quantité de diester contenue dans 5 mL de gazole.
Quantité de matière d'ion oxonium : 17,7 10-3 * 0,100 = 1,77 10-3 mol.
Equation support du titrage : H3O+ aq + HO-aq = 2H2O(l)
Quantité de matière d'ion hydroxyde en excès : 1,77 10-3 mol.
Quantité de matière initiale d'ion hydroxye : 2,5 10-3 * 1,00 = 2,5 10-3 mol.
Quantité de matière de soude ayant réagit avec le diester : 2,5 10-3 -1,77 10-3 = 7,3 10-4 mol.
Quantité de matière de diester : 7,3 10-4 mol.
La densité du gazol est d = 0,84 et la formule du diester est C19H34O2.
Calculer le pourcentage massique du diester dans le gazole.
M(diester) = 19*12+34+32=294 g/mol ; masse de diester : 294*7,3 10-4 = 0,2146 g ;
masse de 5 ml de gazole : 5 *0,84 = 4,2 g ; % massique de diester : 0,2146 / 4,2 *100 = 5,1 %.
|
Qualité d'une essence.
Pour une essence, l'indice d'octane rend compte de la capacité d'un
carburant à être comprimé sans exploser spontanément. Le tableau
suivant donne l'indice d'octane RON pour différents composés ( pour un
moteur à bas régime ).
Rappeler comment est défini l'indice d'octane d'une essence. Dessiner la formule topologique des deux composés de référence.
Un carburant a un indice
d'octane de 95, lorsque il se comporte, au point de vue auto-allumage, comme un mélange de 95% d'iso-octane ( résistant à
l'auto-inflammation : son indice est de 100 par définition) et de 5% de n-heptane (il s'auto-enflamme
facilement et son indice est de 0 par définition).

|
Indiquer comment va évoluer l'indice d'octane d'une essence en fonction de :
- la longueur de la chaine carbonée d'un alcane linéaire
- la ramification des chaines carbonées
- la présence de noyau(x) aromatique(s).
composé
|
tempérture d'ébullition °C
|
indice d'octane RON
|
butane
|
-0,4
|
95
|
pentane
|
36
|
62
|
2-méthylbutane
|
28
|
92
|
2,2-diméthylpropane
|
50
|
80
|
hexane
|
69
|
25
|
2-méthylpentane
|
60
|
73
|
2,2-diméthylpentane
|
79
|
92
|
heptane
|
98
|
0
|
2-méthylhexane
|
90
|
42
|
2,2-diméthylpentane
|
79
|
93
|
2,2,3-triméthylbutane
|
81
|
112
|
octane
|
125
|
< 0
|
benzène
|
80
|
110
|
toluène
|
110
|
120
|
ETBE
|
73
|
120
|
L'indice d'octane diminue lorsque la chaine carbonée linéaire grandi.
L'indice d'octane augmente avec le nombre de ramifications.
L'indice d'octane d'un composé aromatique est supérieur à 100.
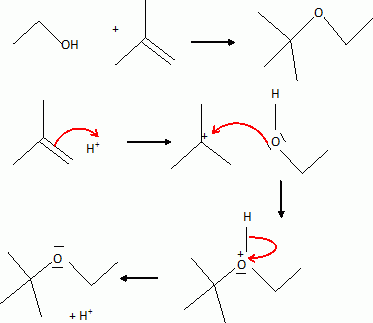
L'ETBE ( éthyltertiobutyléther)
ajouté à l'essence est synthétisé par réaction de l'éthanol avec
le 2-méthylpropène en présence d'acide comme catalyseur..
Ecrire l'équation de la réaction et proposer un mécanisme.
Fabrication d'une essence.
On se propose de revoir de façon simplifiée les différentes étapes pour obtenir une essence.
Distallisation fractionnée du pétrole.
On cherche à modéliser la distillation fractionnée à partir d'un système binaire simple hexane- octane.
Expliquer pourquoi on peut considérer que le mélange liquide des deux alcanes est un mélange idéal.
Microscopiquement la solution se comporte comme un liquide pur : les
interactions entre molécules différentes et molécules identiques sont égales. Il
faut pour cela que les molécules soient assez semblables ( hexane octane).
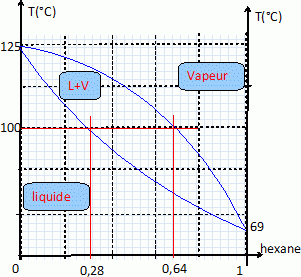
Pour chaque constituant, à l'équilibre pour une température T, la composition en fraction molaire de la vapeur est donnée par yi et celle de la phase liquide est donnée par xi. Si T = 100°C, les coordonnées des courbes d'ébullition et de rosée sont, pour l'hexane, xh =0,28 et yh=0,64.
Donner
l'allure du diagramme binaire liquide- vapeur isobare pour le mélange
hexane-octane en prenant comme abscisse la fraction molaire d'hexane.
On
considère un mélange de 100 g d'hexane et de 95 g d'octane. Ce mélange
est vaporisé entièrement à la température de 130°C puis refroidi
progressivement jusqu'à une température de 100°C.
Calculer la masse de liquide obtenue et donner sa composition en masse d'octane et d'hexane.
M(C6H14) =6*12+14=86 g/mol ; n(hexane) = 100/86 =1,16 mol ;
M(C8H18) =6*12+14=114 g/mol ; n(hexane) = 95/114 =0,833 mol ;
ntotal ~ 2,0 mol ; fraction molaire : xH =1,16 / 2 =0,58.
théorème des moments chimiques :
Le point M à l'intérieur du fuseau indique que nous sommes en présence
du mélange liquide + vapeur ; il nous renseigne aussi sur les proportions
respectives du liquide et de la vapeur. Le mélange comporte Nliq mol de liquide et
Nvap mol de vapeur.
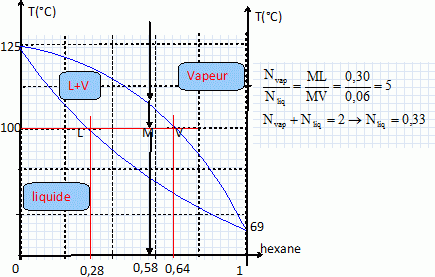
Composition du liquide : la fraction molaire d'hexane est 0,28, celle d'octane 0,72.
soit 0,333*0,28 = 0,093 mol d'hexane et 0,333*0,72 =0,24 mol d'octane
soit 0,093 *86 =8,0 g d'hexane et 0,24 *114 =27,4 g d'octane.
Expliquer en 5 lignes au plus le principe de la distillation fractionnée ( un schéma simplifié annoté est demandé).
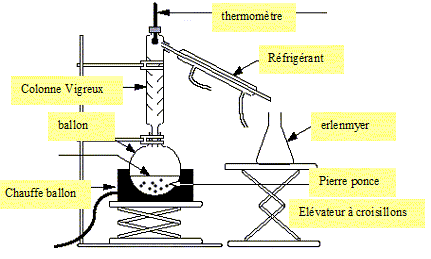
La distillation
fractionnée permet de séparer les
constituants d'un mélange liquide- liquide
miscibles, possédant des températures
d'ébullition différentes.
Le constituant le plus
volatil distille en premier ; la séparation
est d'autant plus facile que les
températures d'ébullition sont
différentes.
Les vapeurs montent dans la colonne de Vigreux, elles se refroidissent et se
condensent sur la surface interne de la colonne (les aiguilles ).
Ce liquide, chauffé progressivement par les autres vapeurs montantes se
vaporise à nouveau : cette vapeur est enrichie en composé le plus
volatil.
On donne le schéma général du raffinage d'une essence.
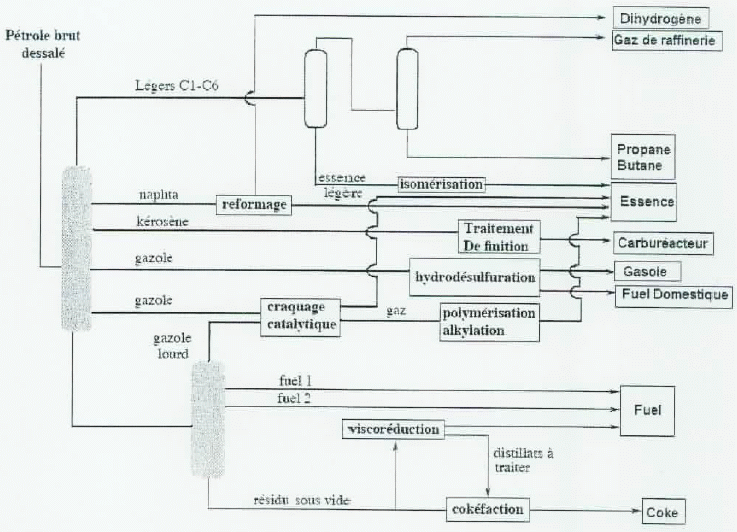
|
Indiquer le rôle du craquage catalytique et du reformage pour la fabrication d'une essence.
Lors du craquage catalytique, les grosses molécules d'alcanes se brisent.
Lors du reformage, les constituants naphténiques (à bas indice d'octane) sont transformés en constituants
aromatiques à haut indice d'octane.
Expliquer pourquoi lors de l'obtention des fuels, ces traitements ne sont pas effectués. Que signifie "hydrodésulfuration" ?
Dans un moteur diesel, le gasoil injecté sous forte pression ( 100 à
300 bars) s'enflamme spontanément au contact de l'air comprimé et
surchauffé. L'air est comprimé ; le carburant n'est pas comprimé, donc
pas de risque d'auto-inflammation.
Hydrodésulfuration : enlever le soufre
contenu dans lesgazole et kérosène. En présence de dihydrogène on forme du sulfure d'hydrogène.
Reformage.
Le reformage catalytique est effectué vers 500°C en présence de
catalyseur ( platine - rhénium ) et permet en particulier des
réactions de déshydrocyclisation (1), d'aromatisation (2) ou
d'isomérisation (3). Pour modéliser les réactions de reformage, on
considère ces réactions à partir de l'hexane pour lesquelles on donne
les enthalpies libres standards de réaction et les enthalpies standards
de réaction, toutes les espèces étant à l'état gazeux.
L'enthalpie standard de réaction est considérée indépendante de la température.
déshydrocyclisation (1) : n-C6H14 = C6H12 + H2. DrG°1 =25 kJ/mol et DrH°1 =40 kJ/mol
aromatisation (2) : n-C6H14 = C6H6 + 3H2. DrG°2 =85 kJ/mol et DrH°2 =210 kJ/mol
isomérisation (3) : n-C6H14 = 2-méthylpentane. DrG°3 =3 kJ/mol et DrH°2 =-4 kJ/mol
Quelle réaction est favorisée à 500°C et en conclure, pourquoi le reformage permet d'augmenter l'indice d'octane d'une essence.
L'aromatisation (2) est fortement endothermique ( DrH°2
=210 kJ/mol) : elle est favorisée par une augmentation de la
température. Le benzène possèdant un indice d'octane élévé (
110), l'indice d'octane de l'essence sera augmenté.
|
|





