Réactions
de combustion et transfert thermique.
Rappeler
en une phrase le premier principe de la thermodynamique et exprimer la
variation de l'énergie interne et la variation d'enthalpie d'un système
physico-chimique au repos en considérant seulement le travail des
forces de pression.
Au cours d'une transformation d'un système fermé,
la variation de son énergie est égale à la quantité d'énergie échangée
avec le milieu extérieur, sous forme de chaleur et de travail.
DU = W + Q.
Travail des forces de pression à pression constante W = -P(Vfin
- Vdébut ).
DU =Ufin - Udébut = Q -P(Vfin -
Vdébut ) ; Q = Ufin +PVfin -Udébut-
PVdébut ;
On définit ainsi une autre fonction d'état, la fonction enthalpie : H =
U + PV.
Q = Hfin - Hdébut = DH.
La variation d'enthalpie lors d'une transformation à pression constante
d'un système thermodynamique, est égale à la quantité de chaleur
mise en jeu.
Définir
l'enthalpie de réaction et indiquer comment évolue l'enthalpie d'un
système fermé siège d'une réaction à température et pression constante
en fonction de l'avancement de la réaction.
La plupart des réactions chimiques ont lieu à pression constante.
L'enthalpie de réaction permet de connaître l'énergie libérée sous
forme de chaleur Q = DHT,
p.
Soit x l'avancement de la
réaction : DHT,
p = x DrHT, p
avec DrHT, p :
enthalpie de réaction en J mol-1.
Indiquer à quoi
correspond l'enthalpie standard de formation d'un espèce chimique.
Définir les réactions de formation en prenant comme exemples le
méthane, l'eau et le méthanol.
C'est l'enthalpie standard de réaction DrHT, p de la réaction de formation du corps pur à
partir des corps simples stables dans l'état standard T.
C(graphite) + 2 H2(g) = CH4(g)
H2(g) + ½O2(g) = H2O(liquide)
C(graphite) + 2H2(g) + ½O2(g) = CH4O(liquide).
Le pouvoir énergétique (PE) d'un combustible ( en MJ kg-1)
correspond à la quantité d'énergie libérée lors de la combustion
complète d'un kg du combustible.
Calculer le PE pour
le carbone, le méthane et l'hydrogène
C(graphite ) + O2(g) = CO2 (g) ; DrHT, p =
DfHT, p (CO2 (g)) - DfHT, p (O2 (g))- DfHT, p (C(graphite ))
DrHT, p
=-393 -0 -0 = -393 kJ mol-1 ; PE = -393*1000/12=3,28 104
kJ kg-1 = 32,8 MJ kg-1.
CH4(g) + 2O2(g) = CO2
(g) +2H2O(g) ; DrHT, p =
DfHT, p (CO2 (g)) +2 DfHT, p (H2O(g)) - 2DfHT, p (O2 (g))- DfHT, p (CH4(g))
DrHT, p
=-393 +2*(-242)-0 -(-75) = -802 kJ mol-1 ; PE =
-393*1000/16=5,01 104 kJ kg-1 = 50,1 MJ kg-1.
H2(g ) + ½O2(g) = H2O(g) ; DrHT, p =
DfHT, p (H2O(g) - 0,5DfHT, p (O2 (g))- DfHT, p (H2(g ))
DrHT, p
=-242 -0 -0 = -242 kJ mol-1 ; PE = -242*1000/2=1,21 105
kJ kg-1 = 121 MJ kg-1.
|
Proposer une
expérience simple, montrant les produits obtenus lors de la combustion
du carbone et du gaz de ville. Indiquer dans quelles conditions on peut
obtenir du carbone solide lors de la combustion du méthane.
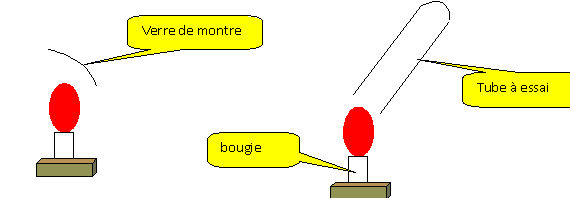
La partie froide du verre de
montre se couvre de buée : la combustion de la bougie produit de l'eau.
Recueillir les gaz issus de la combustion de la bougie dans un tube à
essais. Ajouter dans ce tube 2 mL d'eau de chaux. Boucher et agiter. L'eau de chaux se trouble : la
combustion de la bougie produit du dioxyde de carbone.
La combustion incomplète, dioxygène en défaut ou température peu
élevée, donne du carbone solide.
|
Donner
la composition et une méthode de préparation de l'eau de chaux. Ecrire
les différentes équations des réactions qui interviennent lorsqu'on
fait barboter du dioxyde de carbone en continu dans l'eau de chaux.
Le lait de chaux
est obtenu en mélangeant dans un bécher un peu de chaux éteinte (
solide blanc) avec 100 mL d'eau. Laisser décanter ;
filtrer : le filtrat obtenu est l'eau de chaux. L'eau de chaux est une
solution saturée d'hydroxyde de calcium Ca(OH)2.
Le dioxyde de carbone, en présence d'eau de
chaux Ca(OH)2 donne un solide CaCO3.
Ca(OH)2 + CO2(g)
= CaCO3 (s) + H2O(l).
Le dioxyde de carbone en barbotant longtemps, réagit avec l'eau, donne
un acide : le pH va donc diminuer et on observe une redissolution du
solide CaCO3 selon : CaCO3 (s) +CO2
(aq) + H2O = Ca2+ + 2HCO3-.
Un élève observe que lorsqu'on fait barboter de l'air dans l'eau de
chaux, il ne se passe rien mais que si l'air est inspiré puis expiréà
l'aide d'une paille dans de l'eau de chaux le test est positif.
Proposer
une explication à cet élève en justifiant la présence de l'élément
carbone.
A l'intérieur des cellules de l'organisme, les réaction
oxydantes consomment de l'oxygène pour dégrader des matières organiques
comme le glucose ou les lipides. Ce sont ces réactions qui produisent
du CO2.La respiration, mouvement d'inspiration ( apport de
dioxygène ) -expiration ( rejet de dioxyde de carbone ) ventile le sang.
Le charbon.
Les réserves mondiales de charbon sont extrêmement importantes et
constituent pour certains pays la première source d'énergie. Le charbon
peut être utilisé directement comme combustible ou pour la production
de dihydrogène.
Les oxydes de carbone.
Préciser
le nombre d'oxydation maximal de l'élément carbone. + IV.
Donner
les schémas de Lewis du monoxyde de carbone et du dioxyde de carbone.
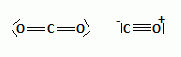
Le monoxyde de carbone est un composé toxique.
Indiquer
quel type de réaction intervient lors de l'empoisonnement avec du
dioxyde de carbone. Que peuvent faire les pompiers pour essayer de
sauver une personne subissant cet empoisonnement ?
Le CO se lie aux sites ferreux de l'hémoglobine, formant la
carboxyhémoglobine, effet qui diminue la capacité de transport en
oxygène du sang. Il faut soustraire immédiatement la victime de
l'exposition, et lui faire inhalé du dioxygène pur à l'aide d'un masque
à oxygène bien ajusté.
Stabilité thermique des
oxydes de carbone.
Indiquer
en quoi consiste l'approximation d'Ellingham.
On se place dans le cadre de l'approximation d'Ellingham : DrH° et DrS°
ne dépendent pas de la température ( hors changement de phase ).
On donne le diagramme d'Ellingham pour C, CO et CO2 relatif
à une mole de dioxygène.
Compléter
ce diagramme en précisant les espèces qui prédominent dans les
différents domaines.
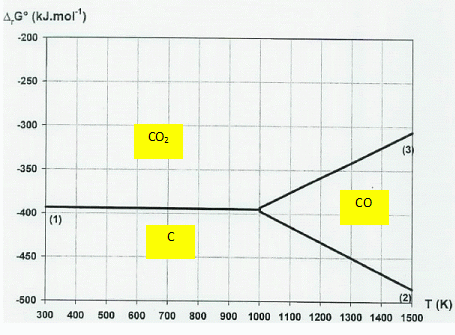
composé
|
C(s)
|
CO(g)
|
CO2(g)
|
O2(g)
|
DfH° kJ mol-1
|
0
|
-110
|
-393
|
0
|
S°
J mol-1 K-1
|
6
|
197
|
213
|
205
|
Donner
l'équation des droites du diagramme.
(1) :
C(s) + O2(g) = CO2(g) ; DrH° = DfH°(CO2(g))=
-393 kJ mol-1 = -3,93 105 J mol-1.
DrS° =S°(CO2(g))
- S°(C(s)) -S°(O2(g)) = 213-6-205=2 J mol-1 K-1.
DrG° =DrH° -TDrS° = -3,93 105 -2T.
(2) :
2C(s) + O2(g) = 2CO(g) ; DrH°
= 2DfH°(CO(g))=
-220 kJ mol-1 = -2,2 105 J mol-1.
DrS° =2S°(CO(g)) -
2S°(C(s)) -S°(O2(g)) = 2*197-12-205=177 J mol-1 K-1.
DrG° =DrH° -TDrS° = -2,2 105 -177T.
(3) :
2CO(g) + O2(g) = 2CO2(g) ; DrH° = 2DfH°(CO2(g))
- 2DfH°(CO(g))=
-2*393+2*110=-566 kJ mol-1 = -5,66 105 J mol-1.
DrS° =2S°(CO2(g))
- 2S°(CO(g)) -S°(O2(g)) = 426-6-2*197-205= -173 J mol-1
K-1.
DrG° =DrH° -TDrS° = -5,66 105 +173T.
Ecrire
l'équation de l'équilibre de Boudouard entre le carbone et ses deux
oxydes et calculer la variance de cet équilibre.
C(s) + CO2(g) = 2 CO(g)
3 constituants ; une relation entre les constituants ; 2 facteurs
physiques et 2 phases ( solide et gaz) : v = 3-1+2-2 =2.
Transformation du charbon en gaz
de synthèse.
Le charbon peut être utilisé pour la
production de dihydrogène par réduction de la vapeur d'eau.
Tracer
sur le diagramme précédent la droite correspondant au couple H2O(g)
/ H2(g).
2H2(g) + O2(g) = 2H2O(g) ; DrH° =-2*242 = -484 KJ
mol-1 = -4,84 105 J mol-1.
DrS° =2S°(H2O(g))
- 2S°(H2(g))
-S°(O2(g)) = 2*189-2*130-205= -87 J mol-1 K-1.
DrG° =DrH° -TDrS° = -4,84 105 +87T.
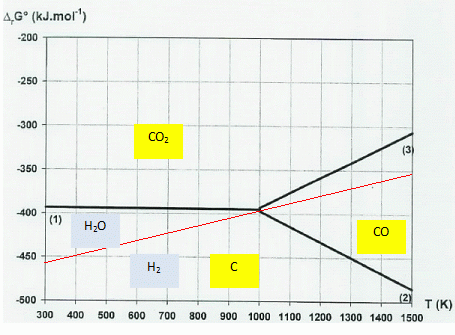
Déterminer
les équilibres à considérer lorsque la vapeur d'eau est projetée sur du
carbone en excès à T = 800K et T = 1300 K.
T= 800 K : C(s) + 2H2O(g) = 2H2(g) + CO2(g).
(1)
T= 1300 K : CO(g) + H2O(g) = H2(g) + CO2(g).
(2)
Calculer les
constantes d'équilibre correspondant aux équilibres précédents.
(1) : DrH° = DfH°(CO2(g))-2
DfH°(H2O(g))=
-393-2(-242) =91 kJ mol-1 = 9,1 104
J mol-1.
DrS° =S°(CO2(g))
+2S°(H2(g))-
S°(C(s)) -2S°(H2O(g))
= 213+260-6-2*189=89 J mol-1 K-1.
DrG° =DrH° -TDrS° = 9,1 104 -800*89
=19800 J mol-1.
DrG° = -RT
ln K1 ; ln K1 = -19800 / (8,31*800) = -2,98 ; K1 = 0,051.
(2) : DrH° = DfH°(CO2(g))-
DfH°(H2O(g))-DfH°(CO(g)) = -393-(-242)-
(-110) = -41 kJ mol-1 = -4,1 104 J mol-1.
DrS° =S°(CO2(g))
+S°(H2(g))-
S°(CO(g)) -S°(H2O(g))
= 213+130-197-189= -43 J mol-1 K-1.
DrG° =DrH° -TDrS° = -4,1 104
+1300*43 =14900 J mol-1.
DrG° = -RT
ln K2 ; ln K2 = -14900 / (8,31*1300) = -1,38 ; K2 = 0,25.
On veut
favoriser la formation de dihydrogène : il vaut mieux travailler
à haute température ( K2 > K1)
Les
carburants.
Les carburants constituent environ 80 % des produits issus du
traitement du pétrole. Les essences et le gazole peuvent être
considérés comme un mélange d'alcanes non cycliques.
Combustion des
carburants.
La combustion des carburants constitue la principale source énergétique
utilisée pour les transports. En plus de la diminution importante
des réserves fossiles, leur utilisation massive crée des problèmes
environnementaux. L'émission de dioxyde de carbone par un véhicule est
actuellement une donnée importante qui est mise en avant pour l'achat
d'un véhicule.
Indiquer
l'impact sur l'environnement d'une émission importante de dioxyde de
carbone.
Le dioxyde de carbone est un gaz à effet de serre : il contribue au
réchauffement global de la planète.
Donner la
formule d'une autre espèce chimique courante qui pose le même problème.
Le méthane CH4, le protoxyde d'azote N2O.
La consommation d'un véhicule et l'émission de CO2 doivent
obligatoirement apparaître dans la fiche technique ou sur tout
affichage publicitaire. Pour une voiture à essence de 120 ch les
données suivantes sont indiquées : - consommations en cycle urbain 11,2
L/100 km ; cycle extra-urbain : 6,4 L/100 km ; cycle mixte : 8,2 L /
100 km. Emission de CO2 : 194 g/km.
Au n iveau d'une classe de 1è S, on veut lors d'un exercice
de contrôle, mettre en évidence la relation entre la consommation du
véhicule et l'émission de CO2 qui est indiquée. L'essence
sera considérée comme un mélange d'isomère d'octane avec une densité de
0,76.
Rédiger
l'énoncé, justifier les étapes du questionnement retenu, donner la
résolution complète de l'exercice.
L'essence sera considérée comme un mélange d'isomère d'octane C8H18
avec une densité de 0,76. La consommation du véhicule, en cycle mixte (
ville et campagne) et 8,2 L/100 km. On désire retrouver par le calcul,
l'indication de la fiche technique "194 g de CO2 par km".
Ecrire l'équation de la combustion complète de l'octane ; les produits
sont l'eau et le dioxyde de carbone.
C8H18
(l)+ 12,5O2(g) =8 CO2 (g)+ 9H2O(g)
Calculer la masse molaire de l'octane. M = 8*12+18 =114 g/mol.
Calculer la masse de 8,2 L d'essence. m = 8,2 * 0,76 = 6,232 ~6,2 kg
Calculer la quantité de matière d'octane : n = m/M = 6232/114 = 54,67 ~
55 mol.
En déduire la quantité de matière de CO2 ( on pourra dresser
un tableau d'avancement) : 8*54,67 =437,3 mol.
En déduire la masse de CO2 produit pour 100 km puis pour 1
km : 437,3*44 = 19,2 kg soit 0,192 g par km.
Toujours en classe de 1è S, on cherche à calculer l'énergie
totale ( J) dépensée par le véhicule précédent lorsqu'il parcourt 100
km à 90 km/h.
Indiquer
les étapes du raisonnement qui doit être mis en place avec les élèves
pour donner les éléments de réponse à cette question.
Pour calculer la chaleur de réaction de combustion de l'octane, on
considèrera que l'octane est en phase gazeuse.
On donne les enthalpies standard de dissociation de liaison :
liaison
|
C-C
|
C-H
|
C=O
|
O=O
|
OH
|
DdH°( kJ/mol)
|
345
|
415
|
804
|
497
|
463
|
Etablir la liste des
liaisons rompues ( réactifs) et de liaisons créées ( produits).
Calculer l'énergie mise en oeuvre lors de la combustion complète d'une
mole d'octane.
Calculer la masse de 6,2 L d'essence ( 100 km parcourus à 90 km/h).
Calculer la quantité de matière d'octane.
Calculer l'énergie consommée lors de ce trajet.
|
Les
agrocarburants.
L'utilisation des biocarburants, tels que l'éthanol issus de la
biomasse et les esters méthyliques d'huiles végétales ( diester) est
proposée pour diminuer l'inmact de l'émission de dioxyde de carbone par
les moteurs thermiques.
Expliquer
pourquoi l'utilisation des agrocarburants contribue à diminuer
l'émission de dioxyde de carbone.
Lors de leur croissance les plantes fixent le dioxyde de carbone de
l'air. Ces plantes conduisent aux agrocarburants. La combustion des
biocarburants libèrent du dioxyde de carbone. Le bilan carbone est nul.
Donner
la formule générale d'un triglycéride d'une huile végétale.
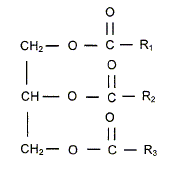
R1, R2,
R3 chaines carbonées saturées ou insaturées.
Un diester est obtenu par traitement de
l'huile végétale par un excès de méthanol soit en présence d'un
catalyseur acide comme l'acide sulfurique, soit par catalyse basique
avec du méthanolate de sodium.
Indiquer
la formule du produit obtenu en plus du diester et donner le nom de la
réaction effectuée.
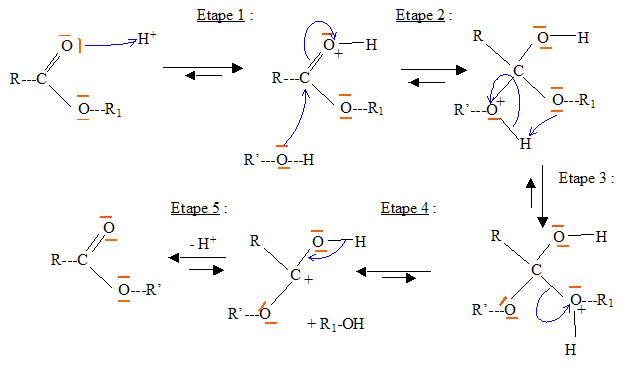
La transestérification
correspond à la réaction chimique suivante :
Ester
1 + alcool = Ester 2 + autre alcool.
La transestérification de glycérides donne du glycérol
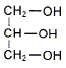 et des eters méthyliques. et des eters méthyliques.
|
|




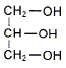 et des eters méthyliques.
et des eters méthyliques.