|
Transformations du jus de raisin : BTS QIABI 2010. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
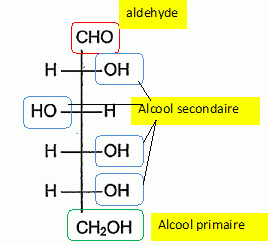
Dans une coopérative agricole, le raisin est déversé sur un tapis roulant qui achemine les grains jusqu'au pressoir. Au cours du pressurage, le jus s'écoule dans des cuves spéciales appelées " belons". On laisse ensuite le jus décanter : c'est le débourbage ; en même temps, on pratique un sulfitage du moût ( c'est à dire le jus de raisin ). Le sulfitage consiste à ajouter de l'anhydride sulfureux ( ou dioxyde de soufre ), d'une part pour protéger le vin de l'oxydation au contact de l'oxygène de l'air et d'autre part pour faciliter la décantation. Le dioxyde de soufre SO2 ajouté va donner des sulfates et de l'acide sulfurique qui vont réagir avec le dioxygène avant les autres corps. La réaction entre l'éthanol et le dioxygène est-elle possible dans les conditions standards ? Justifier. E°( O2/H2O) = 1,23 V ; E°( CH3CHO / CH3CH2OH ) = 0,12 V. E°( O2/H2O) > E°( CH3CHO / CH3CH2OH ) : l'oxydation de l'éthanol par le dioxygène est thermodynamiquement possible. Ecrire la demi-équation en milieu acide du couple ( CH3CHO / CH3CH2OH ). Oxydation de l'alcool : CH3CH2OH = CH3CHO +2H++2e-. Ecrire la demi-équation en milieu acide du couple ( O2/H2O). Réduction du dioxygène : ½ O2+2H++2e- = H2O. Ecrire l'équation bilan de la réaction d'oxydoréduction entre le dioxygène et l'éthanol. CH3CH2OH + ½ O2= CH3CHO + H2O. Donner le nom de la fonction et le nom du composé organique résultant de l'oxydation de l'éthanol. Fonction alehyde ; étahanal CH3CHO. Pompage du moût. On soutire ensuite le moût par pompage. Les "bourbes" et l'écume restent au fond du belon. Le moût est aspiré par une pompe, de débit volumique Qv = 5,56 L s-1, dans une canalisation de diamètre DA =8,0 cm, pour être déversé dans une cuve en inox.
La canalisation subit donc un étranglement en B : son diamètre est DB = 6,0 cm. La différence de pression entre les points A et B est mesurée par deux colonnes verticales. 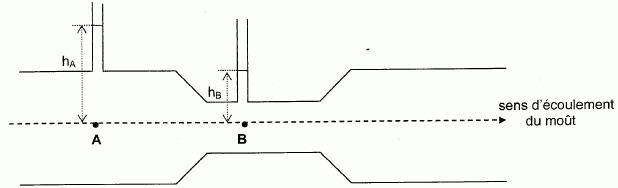 Comparer les vitesses d'écoulement vA et vB en A et B. Justifier. Le débit volumique est constant. La section SA en A est supérieure à la section SB en B. Qv = SA vA = SB vB. SA >SB entraîne vA < vB. De cette variation de vitesse résulte une variation de pression dont on peut déterminer l'expression en appliquant la relation de Bernoulli. On obtient : DP =PA-PB = ½r (1/SB2-1/SA2) Qv2. Calculer DP. Masse volumique du moût r = 1,1 103 kg m-3. SA =5,024 10-3 m2 ; SB =3,14 *0,062/4 =2,827 10-3 m2. DP =0,5*1,1 103 [ 1 / (2,827 10-3)2 -1 / (5,024 10-3)2 ] (5,56 10-3)2 =1,453 103 ~1,5 103 Pa. En admettant que DP = r g Dh, calculer la différence de hauteur de moût dans les colonnes Dh = hA-hB. Dh = DP / ( r g) =1,453 103 / (1100*9,8) = 0,1348 ~0,13 m. Fermentation. Le moût est stocké dans des cuves en inox ou émail thermo-régulées, pour subir la fermentation alcoolique. Elle dure tois semaines à un mois environ : le sucre se transforme en alcool grâce à l'action des levures ; cette réaction s'accompagne d'un dégagement de dioxyde de carbone. La température doit être comprise entre 25°C et 30°C, au delà de 50 °C les levures sont détruites et la fermentation stoppe, c'est pour cette raison que les cuves sont thermo-régulées. Les levures produisent aussi des composés secondaires : alcools supérieurs, acide succinique, etc. On pratique dans certains cas, en particuliers les années de fortes acidités des moûts, la fermentation malolactique. Elle peut être spontanée ou provoquée. Il s'agit d'une transformation de l'acide malique en acide lactique, sous l'action de bactéries spécifiques. l'aspect acide du vin est éliminé. La réaction de fermentation est la transformation du glucose en éthanol avec formation de dioxyde de carbone selon l'équation : C6H12O6 (aq) = 2C2H5OH (aq)+ 2 CO2 (g).
DRH° = 2DfH°(CO2) +2DfH°(C2H5OH) -DfH°( C6H12O6 ) DRH° =2*(-393,5) +2*(-277,6) -(-1260) = -82,2 KJ / mol. DRH° < 0 : la réaction est exothermique ; la température du moût va croître, d'où la nécessité d'une thermo-régulation des cuves.
Déterminer la variation d'entropie standard DRS° de la réaction de fermentation à 298 K. Le signe était-il prévisible ? Justifier.
|
|||||||||||||||||||||
| |
|||||||||||||||||||||
|
|