Partie 3.
(3 points)
L'alumine Al2O3(s) est une forme déshydratée de
l'hydroxyde d'aluminium. L'ion aluminate est une espèce soluble de
formule AlO2-aq.
D'après
le diagramme potentiel-pH, préciser pour les zones A, B, C et D, s'il
s'agit d'une zone de corrosion, passivation ou d'immunité.
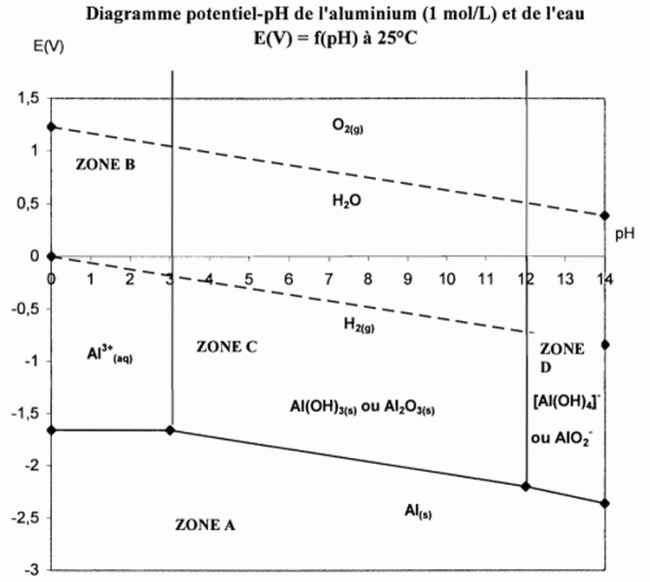
Zone A : zone de
stabilité thermodynamique du métal Al, donc immunité thermodynamique.
Zone B :
l'élément aluminium est sous forme d'ion Al3+aq en solution
donc corrosion.
Zone C : l'élément
aluminium est sous forme d'oxyde Al2O3(s)
protecteur
du métal, donc passivation.
Zone D : l'élément
aluminium est sous forme d'ion AlO2-aq en solution donc
corrosion.
|
Un étudiant affirme
: " le dioxygène dissout réagit avec le métal aluminium quel que soit
la valeur du pH".
A-t-il
raison ou tord ?
Al et O2
appartiennent à des domaines disjoints quel que soit le pH. Le
dioxygène est capable d'oxyder le métal quel que soit le pH. L'étudiant
a raison.
|
L'eau réagit
avec le métal aluminium, quel que soit le pH.
Justifier
cette affirmation. Ecrire le bilan de cette réaction à pH=7.
Couples redox : Al2O3(s)
/Al(s) et H2O(l) / H2(g).
Al et H2O
appartiennent à des domaines disjoints quel que soit le pH. L'aluminium
est capable de réduire l'eau quel que soit le pH.
2 Al(s) +3H2O(l)= Al2O3(s)
+ 6e- + 6H+.
3 fois { 2H++2e- =
H2(g) }.
2 Al(s) +3H2O(l)= Al2O3(s)
+ 3H2(g).
Décrire
succinctement le phénomène de passivation.
En
présence de dioxygène de l'air le métal aluminium s'oxyde en
alumine : cette oxyde forme une couche protectrice. Le métal n'étant
plus en contact avec le dioxygène, l'oxydation s'arrête.
Au
niveau de l'anode de la cellule d'électrocoagulation, l'aluminium
réagit spontanément en présence de dioxygène et d'eau pour former une
couche d'oxyde d'alumine. On se demande alors comment dans la pratique
l'EC peut être efficace pour les pH intermédiaire ( 5 à 8 ).
Comment l'anode en
aluminium recouverte d'alumine peut-elle être dissoute en ion Al3+
aq ?
Lorsque la différence de potentiel appliquée entre les deux électrodes
est suffisamment importante, et grâce à la présence d'ion chlorure (
éventuellement rajoutés à l'effluent ), la corrosion a lieu par
piqûres. Les ions chlorures fragilisent les couches successives
d'alumine plus ou moins poreuses.
Partie 4.
( 4 points ).
Un pilote d'électrocoagulation est constitué d'une cuve et de deux
électrodes reliées à un générateur de courant continu. Les électrodes
sont des plaques d'aluminium rectangulaires de surface active S de 175
cm2 et distantes de L = 2,0 cm. L'intensité de travail
I est de 5,0 A. Une pompe alimente le pilote en effluent d'une
inductrie textile, avec un débit D de 600 L h-1.
L'effluent traité présente une conductivité g de 2,4 mS cm-1.
On donne l'expression de la résistance de
l'effluent entre les électrodes R = L / (gS) en ohm.
Calculer la résistance de la solution entre les électrodes.
gS
= 2,4*175 = 420 mS cm = 0,42 S cm ; 1
/ (gS) =2,38 S-1 cm-1 ; L / (gS) =2,0 *2,38 =4,76 ~4,8 S-1 ou W.
Exprimer
et calculer la puissance dissipée par effet Joule lorsque le module
d'électrocoagulation fonctionne.
P = R I2
=4,76 *5,02 = 119 ~ 1,2
102 W.
Vérifier que
l'énergie dissipée par effet Joule en une heure est 4,3 105 J.
W = P t = 119*3600 = 4,3 105 J.
|
On réalise un bilan énergétique sur une heure de fonctionnement du
module.
Evaluer
la variation de température
DT au
cours du traitement de l'effluent.
On donne ceffluent =4185 J kg-1 K-1 ; reffluent =1000 kg m-3.
Masse d'effluent par heure : m =D
reffluent
=0,600*1000 = 600 kg h-1.
Energie reçue par l'effluent : m ceffluent
DT = 4,3 105
J.
DT =4,3
105 / (600*4185) =0,17 °C.
En
appliquant la loi de Faraday, évaluer la variation de la masse de
l'anode en aluminium Dm après une heure de
fonctionnement.
Quantité d'électricité : Q = I t = 5,0*3600 =1,8 104 C.
Quantité de matière d'électrons : ne- = 1,8
104 /96485 =0,1866 mol.
Al(s) = Al3+aq + 3e-.
Quantité
de matière d'aluminium n = ne-
/3 = 6,22 10-2 mol.
Dm = n M(Al) = 6,22
10-2*27 =1,68 ~1,7
g h-1.
|
|
|
|
