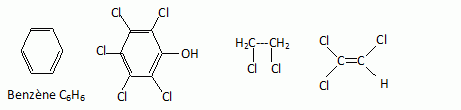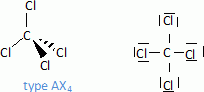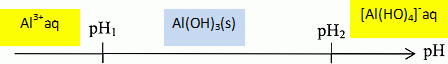Partie 1.
(4 points)
Ecrire
les formules du benzène, du 1,2-dichloroéthane, le pentachlorophénol,
le trichloroéthylène ou 1,1,2-trichloroéthène.
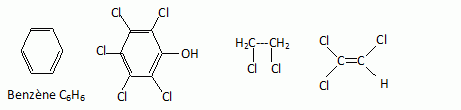
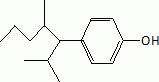
Ecrire la
formule semi-développée du 1,4-hydroxynonylbenzène ou paranonylphénol.
Donner la
représentation de Lewis du tétrachlorure de carbone puis le type de
géométrie spatiale de cette molécule selon la méthode VSEPR. En faire
la représentation.
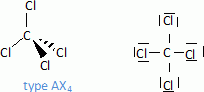
Electrocoagulation,
traitement de l'eau polluée.(9 points )
Le coagulant est libéré dans l'effluent in situ, en utilisant la
dissolution d'une anode sacrificielle, le plus souvent en aluminium ou
en fer. Lors de l'alimentation des électrodes en courant, il y a
simultanément une dissolution du métal à l'anode et un dégagement de
dihydrogène au voisinage de la cathode.
La dissolution de l'anode conduit à la formation d'hydroxydes
métalliques entre autre. Ces composés sont généralement une meilleure
efficacité de coagulation que celle des produits chimiques utilisés
dans les techniques conventionnelles ( ajout de sulfate d'aluminium ou
de chlorure ferrique. Le dégagement de dihydrogène sous forme de bulles
contribue fortement à l'agitation du milieu et, dans certains cas,
favorise la flottation des solides formés ( absorbant-polluant ).
|
Soit
la description simplifiée d'un module d'électrocoagulation : deux
électrodes, dont une anode en aluminium, sont reliées à une source de
courant continu et plongent dans le bac contenant un effluent aqueux à
traiter.
La nature de la cathode n'a pas besoin d'être précisée dans l'étude à suivre.
Le couple mis en jeu à l'anode est Al3+aq/ Al(s).
Donner pour chaque espèce le degré d'oxydation.
Le degré d'oxydation de l'aluminium est nul dans Al(s) et vaut + III dans l'ion Al3+aq.
|
Ecrire la réaction à l'anode. S'agit-il d'une oxydation ou d'une réduction ?
Une oxydation se produit à l'anode positive : Al(s) = Al3+aq + 3e-.
A la cathode, l'eau est la source de dégagement de dihydrogène. Le couple redox mis en jeu est H2O(l) / H2(g).
Ecrire
la réaction à la cathode, en milieu acide, puis en milieu basique.
Réduction à la cathode négative : 2e- + 2 H+aq = H2(g) en milieu acide.
2H2O(l) +2e-= H2(g) +2HO-aq en milieu basique.
S'agit-il d'une oxydation ou d'une réduction ? Justifier.
H+aq ou H2O(l) gagnent des électrons ; ce sont des oxydant qui se réduisent ( réduction).
On veut calculer la tension à appliquer au module d'électrocoagulation dans le cas d'un milieu acide.
Donner les relations de Nernst pour les deux couples précédents.
E1 = E°( Al3+aq/ Al(s)) + 0,02 log [ Al3+aq].
E2 = E°( H+aq/ H2(g)) + 0,03 log( [ H+aq]2 / PH2).
Calculer le potentiel de chaque électrode à pH=3.
Potentiel standard à pH=0 : E°( Al3+aq/ Al(s))= -1,66 V ; E°( H+aq/ H2(g)) = 0,00 V ; PH2= 1 bar ; [ Al3+aq] = 1 mol/L.
E1 = -1,66 V ; E2 =0,00 + 0,03 log 10-6 = -0,18 V.
En déduire la tension minimale théorique à appliquer pour observer la dissolution de l'électrode d'aluminium à pH=3.
E1 - E2 =-0,18 +1,66 = 1,48 ~1,5 V.
Comment expliquer, qu'en pratique, il faut imposer une tension supérieure à celle calculée précédemment.
Certaines réactions sont lentes ; le dihydrogène peut s'adsorber sur la cathode.
Lors
du fonctionnement du module d'électrocoagulation, l'espèce aluminium
apparaît majoritairement en fonction du pH, soit sous forme d'ion Al3+aq, soit sous la forme d'hydroxyde d'aluminium Al(OH)3(s), soit sous forme de complexe tétrahydroxoaluminate (III) [Al(OH)4]-aq.
Ecrire l'équation de la réaction de précipitation de
Al(OH)3(s).
Al3+aq+ 3HO-aq =Al(OH)3(s)
Soit pH1, le pH de début de précipitation de Al(OH)3(s).
Le calculer pour une concentration en Al3+aq notée C1 = 1,00 mol/L.
On donne le produit de solubilité de Al(OH)3(s) : Ks1 = 10-33.
Ks1 = 10-33 =[Al3+aq][HO-aq]3 ; [HO-aq]3 =10-33 ; [HO-aq] = 10-11 mol/L ;
[H3O+aq] = 10-14 / [HO-aq]= 10-14 / 10-11 = 10-3 mol/L ; pH1 = 3,0.
Soient les réactions : Al(OH)3(s) +HO-aq = [Al(OH)4]-aq ; K2.
Al3+aq + 4 HO-aq = [Al(OH)4]-aq ; K3 = 1035 à 25°C.
Exprimer les constantes d'équilibre K2 et K3.
K2= [[Al(OH)4]-aq] / [HO-aq]. K3= [[Al(OH)4]-aq] / ([HO-aq]4[Al3+aq] ).
En déduire l'expression de K2 en fonction de K3 et Ks1. Calculer K2.
Ks1= ([HO-aq]3[Al3+aq] ).
K3= [[Al(OH)4]-aq] / ([HO-aq]4[Al3+aq] ) = [[Al(OH)4]-aq] /( [HO-aq]Ks1)= K2 /Ks1.
K2= K3 Ks1= 1035 10-33 =100.
|
Vérifier que le pH de redissolution totale de l'hydroxyde Al(OH)3 (s) est à 25°C : pH2 = 12.
K2= [[Al(OH)4]-aq] / [HO-aq] avec [[Al(OH)4]-aq] = 1,00 mol/L.
[HO-aq] = 1/K2 : 1 / 100 = 10-2 mol/L.
[H3O+aq] = 10-14 / [HO-aq]= 10-14 / 10-2 = 10-12 mol/L ; pH2 = 12.
Compléter
le diagramme ci-dessous en indiquant sous quelle(s) forme(s)
dissoute(s) se trouve l'espèce aluminium dans les 3 intervalles de pH.
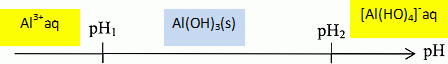
Ceci
justifie que dans la pratiquede l'électrogoagulation, l'opération
s'effectue sur des effluents de pH 5 à 8. Dans ces conditions, la
solubilité de l'hydroxyde amphotère est faible et la présence de
complexes chargés négativement est minimisée. Rappelons que les charges
négatives stabilisent les colloïdes qui ne peuvent plus coaguler.
|
|
|
|