Le
glucose est un des glucides les plus importants et les plus répandus
dans la nature. C'est un aldohexose synthétisé par exemple dans la
feuille des plantes à partir du dioxyde de carbone et d'eau. On se
limitera à l'étude du D-glucose, seul sucre existant dans la nature.
Le D-glucose adopte une configuration de type chaise et en solution, il
existe trois formes en équilibre, par suite d'une réaction
intramoléculaire appelée mutarotation.
Ecrire
l'équation de la réaction traduisant la synthèse d'une molécule de
glucose dans une feuille de plante. Expliquer pourquoi cette réaction
porte le nom de photosynthès .
6CO2 + 6H2O
= C6H12O6 + 6O2.
L'énergie nécessaire à cette synthèse est apportée par la lumière
solaire ( oxydation de l'eau et réduction du dioxyde de carbone ).
Le D-glucose est un
aldohexose.
Préciser
la signification du nom aldohexose et celle du terme D, en illustrant
par une figure. Peut-on préciser le
caractère dextrogyre ou lévogyre de ce glucide ?
"hexa" : six atomes de carbone ; oses : "sucre" ; "ald " : présence
d'une fonction aldehyde.
Le glucose est
un aldohexose, c'est à dire un ose ( corps moléculaire de formule brute
CnH2nOn) possédant
une chaîne carbonée de 6 atomes de carbone et une fonction aldehyde.
Dextrogyre : propriété d'une molécule
de faire dévier le plan de polarisation de la lumière polarisée vers la
droite.
|
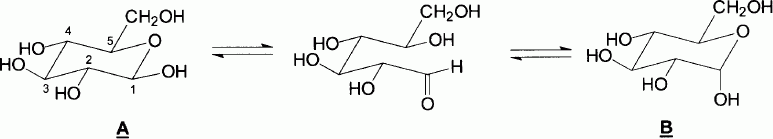
Indiquer
et nommer, sur la structure de la forme ouverte, les deux fonctions
chimiques qui réagissent lors du passage de la forme ouverte aux formes
cycliques A et B. Donner le nom de la nouvelle fonction créée.
La nouvelle fonction créée est un hémiacétal ( formé par la
réactionentre un aldéhyde et un alcool ). La forme
cyclique du glucose porte le nom de pyranose.
|
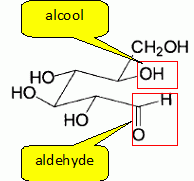
Dessiner A et B en
projection de Newman, selon les axes C1-->C2
et C5-->C4. Indiquer, en justifiant, la forme
prépondérante.
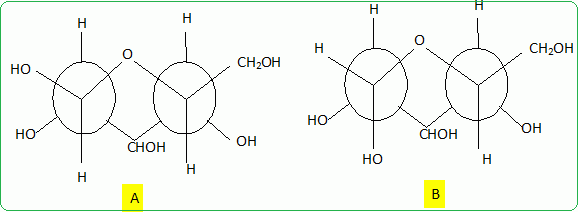
A
est la forme prépondérante, tous les groupes volumineux sont en
position équatoriale. Dans B, un groupe OH est en position axiale.
Indiquer
si A et B sont des isomères de conformations ou de configuration ;
justifier. Comment nomme t-on ce type d'isomèrie, dans ce cas
particulier ?
On passe d'une conformation à une autre par simple rotation autour
d'une liaison simple carbone carbone.
Dans ce cas, on passe de A à B par rupture d'une liaison : A et B sont
des isomères de configuration. Ce sont des énantiomères, appelés
anomères dans le cas des sucres, le carbone 1 change de configuration (
d'où le nom de mutarotation du glucose ).
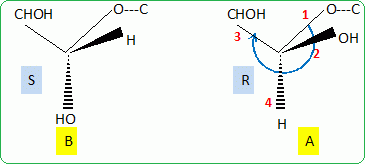
Déterminer
en nomenclature R - S, la configuration absolue de l'atome de carbone 1
dans les formes A et B, en expliquant la démarche suivie.
Numéroter de façon décroissante chacun des quatre substituants selon
son numéro atomique.
On place alors l'atome (ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
Synthèse d'un
acide aminé.
On veut synthétiser la tyrosine, un acide a-aminé essentiel, de formule :
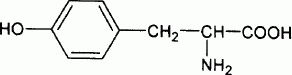
Dans la suite, on pourra utiliser une écriture
des molécules faisant apparaître des charges ( zwitterion ), si besoin
est.
On traite d'abord l'aniline ( phénylamine) par du chlorure d'éthanoyle
en présence de pyridine, ce qui permet d'obtenir un solide C. Le
spectre RMN 1H de C présente un singulet à d = 2,4 ppm ( 3H) ; un massif
complexe à d = 7,3 ppm ( 5
H) et un singulet à d = 8
ppm ( 1 H).
Donner
la formule semi-développée de C. Interpréter le spectre RMN de C.
Préciser le rôle de la pyridine lors de la formation de C. Ecrire
l'équation de la réaction correspondante.
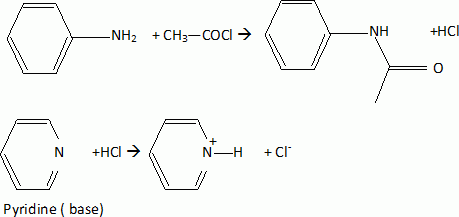
Spectre RMN de C
: le singulet à 2,4 ppm correspond au groupe méthyle en a
du carbonyl ; le singulet à 8 ppm correspond au proton fixé sur
l'azote ; le multiplet à 7,3 ppm correspond aux 5 protons benzéniques.
C est à nouveau traité par le chlorure d'éthanoYle, mais cette
fois, en présence de chlorure d'aluminium anhydre ; on obtient D
majoritairement.
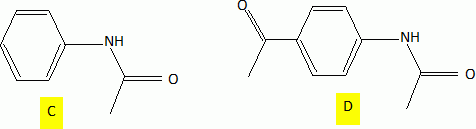
D est ensuite hydrolysé en présence d'acide chlorhydrique concentré. On
obtient un composé ionique E' qui donne E après neutralisation avec un
excès de soude.
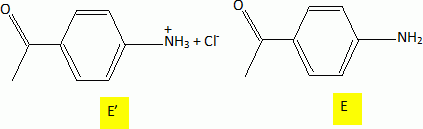
Donner le
nom et le mécanisme détaillé de la réaction de formation de E.
Justifier l'orientation de la réaction, ainsi que l'obtention de E
majoritaire.
Hydrolyse d'un amide en milieu acide, le carbonyle est protoné.
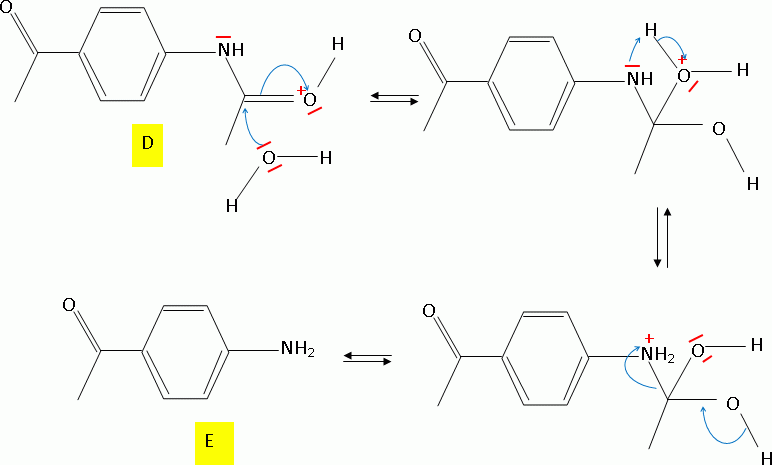
La liaison C=O du groupe CH3-CO fixé sur le
cycle benzénique est conjuguée avec les doubles liaisons C=C du cycle
benzénique. L'atome de carbone de ce groupe est moins déficitaire en
électron que le carbone du groupe amide - HN-CO-. E est donc
majoritaire.
E est soumis à l'action du tétrahydroborate de sodium pour donner F
après hydrolyse. Le spectre IR de F présente deux bandes fines à 3400
et 3450 cm-1 et une bande large et arrondie vers 3300 cm-1.
Interpréter
les données du spectre IR de F.
Bande large et arrondie vers 3300 cm-1 : groupe OH d'un
alcool ; la large bande est due aux liaisons hydrogène.
Deux bandes fines à 3400 et 3450 cm-1 : liaisons N-H, amine
primaire.
Donner la
formule d'un autre réactif utilisable pout transformer E en F. Préciser
les conditions opératoires.
L'addition d'hydrures ( LiAlH4) permet la réduction
sélective du groupement carbonyle en alcool sans toutefois altérer une
double liaison C=C d'une molécule.
Conditions opératoires : 25°C, milieu Et2O anhydre.
Ecrire
l'équation de la réaction de E avec le tétrahydruroborate de sodium.
4 H2N-C6H4-CO-CH3 + NaBH4
+4H2O = 4 H2N-C6H4-CH(OH)-CH3
+Na+ +HO- +B(OH)3.
|
F est ensuite mis en
présence d'acide phosphorique concentré à ébullition ; on obtient,
après neutralisation, G dont la formule semi-développée est donnée :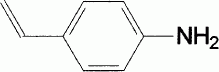
G est traité par le bromure d'hydrogène en présence de peroxyde de
benzoyle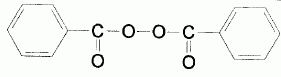 . On obtient H. Donner le nom et le
mécanisme détaillé de l'étape G à H. . On obtient H. Donner le nom et le
mécanisme détaillé de l'étape G à H.
Addition anti-Markovnikov : addition radicalaire
( effet Karasch ).
C6H5CO-O-O-COC6H5
--> 2C6H5CO-O..
C6H5CO-O.+ HBr --> C6H5CO-OH
+ Br..
H2N-C6H4-
CH=CH2
+ Br.--> H2N-C6H4-.CH-CH2Br
( formation du radical le plus stable)
H2N-C6H4-.CH-CH2Br + HBr --> H2N-C6H4-CH2-CH2Br
+ Br..
H réagit avec le cyanure de potassium KCN ; on isole I après
purification.
Indiquer
la structure et le nom de la fonction chimique mise en évidence grâce
au spectre IR de I.
Fonction nitrile 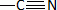 , bande de valence forte ou
moyenne vers 2200 cm-1. , bande de valence forte ou
moyenne vers 2200 cm-1.
I est hydrolysé en milieu acide pour donner J, dont le spectre IR
présente entre autres une bande fine et intense à 1700 cm-1
et une large bande et dentelée de 2800 à 3200 cm-1.
Indiquer la
structure et le nom de la fonction chimique mise en évidence grâce au
spectre Ir de J.
Bande
fine et intense à 1700 cm-1 : liaison C=O d'un acide
carboxylique - COOH.
Large bande et
dentelée de 2800 à 3200 cm-1 : liaison O-H d'un acide
carboxylique.
J réagit ensuite avec
le dibrome en présence de phosphore rouge pour donner K de formule
brute C9H10NO2Br.
K réagit avec le nitrite de sodium dans l'acide chlorhydrique à 5°C :
on forme l'espèce intermédiaire L', qui donne par la suite L et un
dégagement gazeux lorsque la solution est progressivement réchaufée à
60°C.
Ecrire l'équation de
la réaction conduisant de K à L'. Citer le nom de cette réaction.
Diazotation d'un amine aromatique primaire.
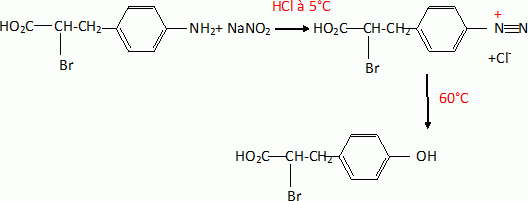
On observe un dégagement de diazote.
L est mis en présence d'un courant gazeux d'ammoniac qui permet de
récupérer, après purification, la tyrosine.
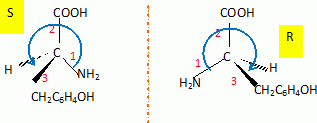
Indiquer
le nombre de stéréoisomères de la tyrosine. Les représenter en
perspective de Cram, en donnant la configuration de chaque carbone
asymétrique et préciser la ( les) relation(s) qui lie(nt) ces
stéréoisomères.
La présence d'un atome de carbone asymétrique conduit à l'existence de
deux énantiomères.
Le spectre RMN13C de la tyrosine fait apparaître notamment
un signal situé à d = 180 ppm.
Attribuer
ce signal.
Il s'agit de l'atome de carbone du groupe COOH.
|
|
|










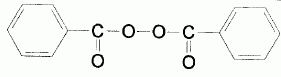 . On obtient H.
. On obtient H. 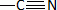 , bande de valence forte ou
moyenne vers 2200 cm-1.
, bande de valence forte ou
moyenne vers 2200 cm-1.
