Le
saccharose, le glucose et le fructose sont des substances optiquement
actives dont les solutions aqueuses suivent la loi de Biot a = [a]20°CD l Cm.
Expliciter
les différents termes intervenant dans cette loi. Préciser les unités
de chacun des termes.
Loi de Biot traduit la
proportionnalité entre le pouvoir rotatoire d'un milieu et les
concentrations en produits optiquement actifs (dextrogyres ou
lévogyres) :
a (°) angle de rotation du plan de vibration des ondes
lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1
); Cm: concentration ( kg m-3 ) ; l
: longueur (m) de cuve.
Ou encore : pouvoir rotatoire spécifique
( ° mL g-1 dm-1 ); Cm:
concentration ( g mL-1 ) ; l : longueur (dm) de cuve.
On
utilise un polarimètre de Laurent pour déterminer le pouvoir
rotatoire spécifique du fructose. Des solutions de différentes
concentrations sont introduites dans un tube polarimétrique de longueur
l = 20,0 cm.
Des solutions de différentes concentrations sont introduites dans le
tube polarimétrique. On mesure leur pouvoir rotaroire à 20°C pour la
raie D du sodium et on obtient le tableau suivant :
Cm(g/L)
|
0
|
20,0
|
40,0
|
60,0
|
80,0
|
100
|
a ( °)
|
0
|
-3,70
|
-7,40
|
-11,1
|
-14,7
|
-18,5
|
La source
lumineuse utilisée est une lampe à vapeur de sodium.
Justifier
ce choix.
Le pouvoir rotatoire spécifique est défini à température donnée et à
une longueur d'onde donnée. La raie D du soduim est une lumière
quasi-monochromatique.
Montrer
graphiquement que ces solutions vérifient la loi de Biot.
|
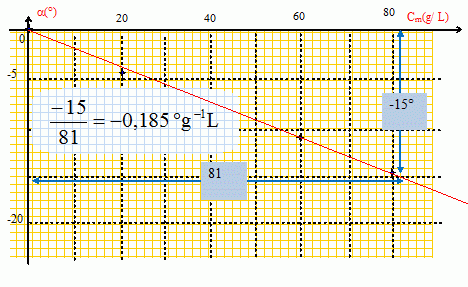
La courbe est une droite passant par l'origine de coefficient directeur
-0,185 ° L g-1. La loi de Biot est donc vérifiée.
|
Déduire de la courbe
le pouvoir spécifique du fructose.
a = [a]20°CD l Cm. Le
coefficient directeur vaut : [a]20°CD l = -0,185 ° L g-1 avec l = 2,00 dm.
[a]20°CD =-0,185 / 2 = -0,0925 ° L
g-1 dm-1 = -92,5 °
mL g-1 dm-1.
Le fructose est-il
dextrogyre ou lévogyre ? Justifier.
Il existe deux variétés de substances optiquement actives : les
substances lévogyres qui font tourner le plan de polarisation vers la
gauche et les substances dextrogyres qui font tourner ce plan vers la
droite.
Par convention, une molécule lévogyre est notée (-), et une molécule
dextrogyre est notée (+) : le fructose est lévogyre.
On considère un volume V = 1,00 L de solution aqueuse S0
contenant un mélange de glucose et de saccharose de concentrations
massiques respectives C0G =40,1 g/L et C0s
=80,3 g/L.
Longueur du tube l =
20,0 cm. Pouvoir rotatoire spécifique du glucose : [aG]20°CD
=0,527 ° m2 kg-1 ; pouvoir rotatoire spécifique
du saccharose : [aS]20°CD
=0,665 ° m2 kg-1 ; pouvoir rotatoire spécifique
du fructose : [aF]20°CD
=-0,920 ° m2 kg-1.
Masse molaire du saccharose MS = 342 g/mol ; masse molaire
du glucose MG = 180 g/mol ; masse molaire du fructose MF
= 180 g/mol.
On mesure dans un premier temps le pouvoir rotatoire a0 de la solution S0
à 20 °C.
Donner l'expression
littérale de a0
puis le calculer.
a0
=( [aG]20°CD
C0G + [aS]20°CD
C0s ) l
avec C0G =40,1 kg m-3 et C0s =80,3 kg m-3et
l = 0,200 m.
a0 =(
0,527*40,1 +0,665*80,3) *0,200 =14,9 °.
Dans un deuxième temps, on réalise l'hydrolyse totale du saccharose
dans le mélange selon l'équation de la réaction chimique suivante pour
obtenir une solution finale Sf.
C12H22011 (saccharose )+ H20
---> C6H1206 (glucose ) + C6H1206
(fructose ).
Montrer
que les quantités de matière initiales en saccharose n0S et en glucose n0G valent
respectivement dans la solution S0, 0 235 mol et 0,223
mol.
n0S = C0s V / MS= 80,3 *1 / 342
=0,235 mol.
n0G = C0G V / MG= 40,1 *1 / 180
=0,223 mol.
Compléter
le tableau d'avancement de cette réaction totale.
équation de la
réaction
|
C12H22011 |
+H20 |
--->
C6H1206(glucose ) |
+ C6H1206
(fructose ) |
|
avancement
|
quantités de matière
(mol)
|
initial
|
0
|
0,235
|
solvant
|
0,223
|
0
|
final
|
xmax
= 0,235
|
0,235
-xmax = 0
|
large
excès
|
0,223
+ xmax
=0,223+0,235
=0,458
|
xmax
= 0,235 |
En considèrant que l'hydrolyse se fait sans variation de volume, déterminer les
concentrations massiques CfG en glucose et CfF en fructose dans la
solution Sf.
CfG =0,458*180 = 82,44 g /L~82,4 g/L et CfF
=0,235*180 = 42,3 g /L.
Donner l'expression
littérale du pouvoir rotatoire af
puis le calculer.
a0
=( [aG]20°CD
CfG + [aF]20°CD
CfF ) l
avec CfG =82,4 kg m-3 et CfF =42,3 kg m-3et
l = 0,200 m.
a0 =(
0,527*82,4 -0,92*42,3) *0,200 =0,902 °.
Produit de
solubilité.
L'hydroxyde
de cuivre (II) Cu(OH)2 (s) est utilisé entre autres por
protéger la vigne contre le mildiou. C'est un sel très peu soluble dans
l'eau. On se propose de déterminer le produit de solubilité de
l'hydroxyde de cuivre (II) de différentes façons. On donne :
E°(Cu2+aq / Cu(s) = 0,337 V. Conductivité équivalente limite
( unité SI) lCu2+aq
= 5,35 10-3 ; lHO-aq = 19,95 10-3
.
La dissociation de l'eau sera considérée comme négligeable.
La solubilité de l'hydroxyde de cuivre (II) dans l'eau pure à 25°C a
pour valeur s = 4,0 10-7 mol/L.
Ecrire l'équation de
dissolution de l'hydroxyde de cuivre (II) dans l'eau pure.
Cu(OH)2
(s) = Cu2+aq + 2HO-aq.
Exprimer
le produit de solubilité Ks en fonction des concentrations
molaires des espèces présentes en solution.
Ks = [Cu2+aq]
[HO-aq]2.
Etablir
l'expression littérale de Ks en fonction de la solubilité s.
Calculer sa valeur.
s = [Cu2+aq]
; la solution est électriquement neutre : [HO-aq]
= 2[Cu2+aq]
= 2 s ; Ks = s (2s)2 = 4 s3 = 4 (4,0 10-7
)3 = 2,56 10-19 ~2,6 10-19.
Le pH d'une solution aqueuse saturée d'hydroxyde de cuivre (II) est
égal à 7,9 à 25°C.
Déterminer la
concentration molaire des espèces présentes en solution.
[H3O+aq]
= 10-pH = 10-7,9 =1,26 10-8 ~1,3 10-8 mo/L.
[HO-aq]
= 10-14 / [H3O+aq]
= 10-14 / 1,26 10-8
=7,94
10-7 ~ 7,9 10-7 mol/L.
La solution est électriquement neutre : 2[Cu2+aq]
+[H3O+aq]=
[HO-aq]
[Cu2+aq]
=½( [HO-aq]
-[H3O+aq]
) =0,5 ( 7,94
10-7 -1,26 10-8
) =3,91 10-7 ~3,9
10-7 mol/L.
En déduire Ks.
Ks = [Cu2+aq]
[HO-aq]2=
3,91 10-7
*(7,94 10-7)2 =2,46
10-19 ~2,5 10-19.
|
La
conductivité d'une solution ionique est donnée par la relation : s = S Li |zi| Ci.
Préciser
la signification de chaque terme et les unités SI correspondantes.
s : conductivité S m-1
; Li
: conductivité molaire limite en S m2 mol-1 ; zi
: valeur absolue de la charge de l'ion ; Ci : concentration
en mol m-3.
La conductivité d'une solution aqueuse saturée d'hydroxyde de cuivre
(II), mesurée à 25 °C, a pour valeur 2,0 10-5 S m-1.
Calculer les
concentrations molaires en ion cuivre (II) et en ion hydroxyde.
L'ion oxonium est négligeable à pH= 7,9. La
solution est électriquement neutre : [HO-aq] = 2[Cu2+aq].
s = 2LCu2+aq [Cu2+aq] +LHO-aq
[HO-aq]
= (LCu2+aq +LHO-aq)
[HO-aq]
[HO-aq] =2,0
10-5 /( 5,35
10-3+19,95
10-3 ) = 7,9 10-4
mol m-3 = 7,9 10-7 mol / L.
[Cu2+aq]=½[HO-aq] =0,5*7,9 10-7 =3,953 10-7~4,0 10-7 mol / L.
En déduire Ks.
Ks
= [Cu2+aq] [HO-aq]2= 3,953
10-7 *(7,90 10-7)2 =2,47 10-19 ~2,5 10-19.
Le potentiel redox d'une électrode constituée d'une lame de cuivre
plongeant dans une solution aqueuse saturée d'hydroxyde de cuivre (II)
est égal à 0,145 V à 25°C.
Exprimer
ce potentiel en fonction de [Cu2+aq]. En déduire Ks.
Cu2+aq +
2e- = Cu(s) ; E1 = E°1 (Cu2+aq / Cu(s)) + 0,03 log [Cu2+aq] = 0,337+0,03 log [Cu2+aq]= 0,145 V.
0,03 log [Cu2+aq]= 0,145-0,337
=-0,192 ; log [Cu2+aq] =-0,192 / 0,03 =
-6,4 ;
[Cu2+aq] = 10-6,4
=3,98 10-7 mol/L.
La
solution est électriquement neutre : [HO-aq] = 2[Cu2+aq] = 7,96 10-7 mol/L.
Ks
= [Cu2+aq] [HO-aq]2= 3,98
10-7 *(7,96 10-7)2 =2,52 10-19 ~2,5 10-19.
Les valeurs trouvées pour Ks sont compatibles entre elles.
Ecart relatif = 100 (plus grande valeur - plus petite valeur ) / valeur
moyenne
= 100 ( 2,52-2,47) / 2,5 = 2 %.
Expliquer qualitativement pourquoi
l'hydroxyde de cuivre est très peu soluble dans l'eau.
Le produit de solubilité est très faible.
|
|
|
|
