|
|
Chimie organique.
(15 points)
On
donne : Cl : Z =17 ; O : Z= 8 ; H : Z=1 ; C : Z =6.
On s'intéresse à l'isomère de configuration absolue R du
2-chloropentane, que l'on appelle A.
Donner la formule
semi-développée de A.
CH3-CH2-CH2-CH Cl CH3.
Qu'appelle
t-on activité optique ?
Les substances chirales présentent une
activité optique :
- les molécules chirales ne sont pas superposables à leur image dans un
miroir
- une molécule
optiquement active, fait tourner vers la droite ou la gauche, le plan
de polarisation de la lumière polarisée.
A possède t-il une activité optique ?
Pourquoi ?
A possède un atome de carbone asymétrique : il possède donc une
activité optique.
Donner
une représentation de Cram de A en justifiant.
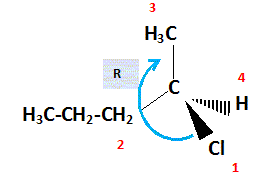
numéroter
de façon décroissante chacun des quatre substituants selon son numéro
atomique.
Cl
(1) ; CH3-CH2-CH2 (2) ; CH3 (3) ; H (4).
On
place alors l'atome (ou le groupement) de numéro le plus élevé derrière.
On
regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3
-
Si le sens de rotation est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
-
Si le sens de rotation est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
Traité
par la soude diluée en solution aqueuse, A donne un seul stéréoisomère
B d'un alcool possédant une activité optique.
Ecrire
l'équation de la réaction.
CH3-CH2-CH2-CH
Cl CH3 + NaOH = CH3-CH2-CH2-CH
OH CH3+ NaCl.
De quel type de
réaction s'agit-il ?
Il s'agit d'une réaction de substitution nucléophile de type SN2.
Détailler
le mécanisme de cette réaction ; donner la
configuration absolue du carbone asymétrique de B.
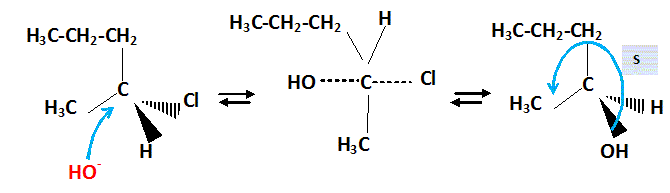
|
|
Quel est le nom
complet de B ?
(S) pentan-2-ol.
|
On fait réagir de l'acide acétique ( éthanoïque)
sur l'alcool B, on obtient un produit C.
Dans cette partie, on ne tient pas compte de la stéréochimie de B.
Ecrire
l'équation de la réaction.
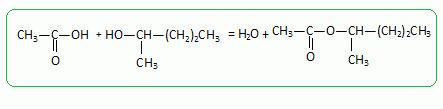
Donner
deux caractéristiques de cette réaction ainsi que le nom du catalyseur.
L'estérification est lente, limitée par l'hydrolyse de l'ester. Elle
est catalysée par les ions oxonium H3O+.
On réalise cette réaction en remplaçant l'acide acétiqe par du
chlorure d'éthanoyle.
Ecrire l'équation de
la réaction.
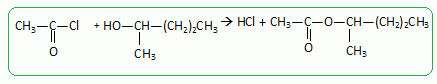
Qu'elle
est l'intérêt de ce changement de réactif ?
La réaction étant totale, le rendement est supérieur à celui de la
réaction précédente.
Equilibres
acido-basiques ( 20 points)
On donne : pKa(H2S /HS- )= 7 ; pKa
( HS- / S2-) = 13 ; n° atomique du soufre Z
= 16.
Zone de virage du BBT(6,0 à 7,6) ; teinte acide : jaune ; teinte
basique : bleue.
Schéma de Lewis
et géométrie :
Donner
la configuration électronique du soufre.
1s2
2s2 2p6 3s2 3p4.
En
déduire le schéma de Lewis de la molécule H2S et celui de l'ion
HS-.
Donner
la géométrie de H2S.
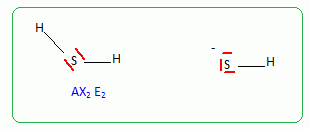
On dispose d'une solution aqueuse S0 de sulfure d'hydrogène H2S
de concentration molaire c0. Lorsqu'on y verse quelques
gouttes de BBT, la solution devient jaune.
Que
peut-on en déduire quant au pH de cette solution ?
L'indicateur coloré étant jaune, le pH est inférieur à 6,0, limite
inférieure de la zone de virage du BBT.
Donner
le diagramme de prédominance des espèces H2S, HS- et S2- en fonction du pH.
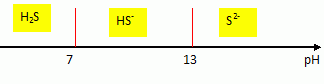
Des
trois espèces, laquelle prédomine dans la solution S0 ?
A pH inférieur à 6, la forme H2S prédomine.
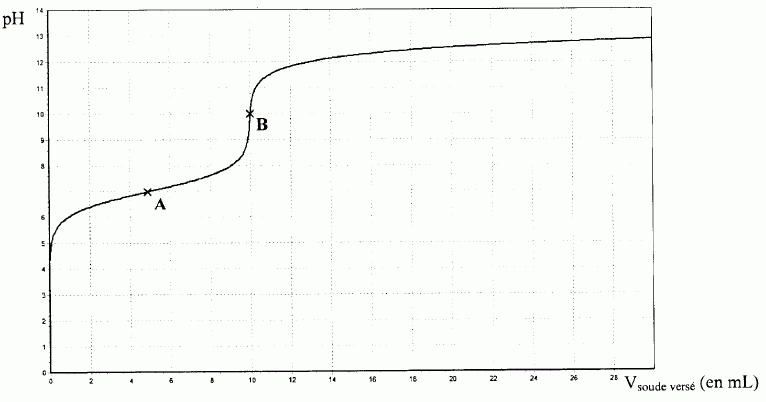
On procède au titrage pHmétrique d'un volume V0 =200,0 mL de S0 par une solution de soude de concentration molaire C1 = 1,0 mol/L. On obtient la courbe ci-dessous :
En s'appuyant sur les valeurs de pKa1 et pKa2, justifier le fait que les deux acidités soient dosées séparément.
On peut doser séparément les deux acidités quand la différence des pKa est supérieure à 4.
Couples acide / base : H2S /HS- et H2O / HO- : H2S + HO- =H2O +HS-. (1)
Constante d'équilibre : K1 =[HS-] /([HO-][H2S]) = [HS-] [H3O+]/([H2S][HO-][H3O+]) = Ka1 / Ke = 10-7 / 10-14 = 107.
Couples acide / base : HS- /S2- et H2O / HO- : HS- + HO- =H2O +S2- . (2)
Constante d'équilibre : K2 =[S2- ] /([HO-][HS-]) = [S2-] [H3O+]/([HS-][HO-][H3O+]) = Ka2 / Ke = 10-13 / 10-14 = 10.
K1 >> K2 : les deux acidités sont dosées séparément.
Pourquoi ne voit-on pas le deuxième saut de pH ?
pKa2 = 13 ; le pH final dans le becher, compte tenu de la dilution sera proche de 13 : le second saut de pH n'existe donc pas.
Ecrire l'équation de la réaction du dosage de la première acidité du sulfure d'hydrogène.
Couples acide / base : H2S /HS- et H2O / HO- : H2S + HO- =H2O +HS-. (1)
Montrer que la concentration molaire C0 est égale à 0,050 mol/L.
A la première équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques :
- quantité de matière de soude : C1 Véq avec Véq = 10,0 mL ( lecture graphe, point B)
- quantité de matière d'acide : C0 V0.
C1 Véq =C0 V0 ; C0 = C1 Véq / V0 = 1,0 *10,0 / 200 =0,050 mol/L.
Justifier par des calculs rapides la valeur du pH aux points A (demi-équivalence) et B.
A la demi équivalence [HS-]= [H2S] et le pH est égal à pKa1 = 7,0.
A l'équivalence : pH = ½(pKa1 +pKa2= =0,5 (7+13) = 10.
On mélange un volume V0 = 200,0 mL de solution aqueuse S0 de sulfure d'hydrogène et un volume V'0= 200,0 mL d'une solution aqueuse de concentration C'0 = 0,050 mol/L en ions cadmium Cd2+.
Il se produit alors de façon rapide et totale la réaction de précipitation d'équation :
H2S + Cd2+ aq +2H2O = CdS(s) + 2H3O+aq.
On considère la quantité de matière en ions H3O+aq négligeable à l'état initial dans le mélange.
Effectuer un bilan de matière pour déterminer la composition finale du mélange.
Quantités de matière initiales :
n(H2S) = V0 C0 =0,20*0,050 =0,010 mol ; n(Cd2+ ) = V'0 C'0 =0,20*0,050 =0,010 mol ;
Les quantités de matière des réactifs sont en proportions stoechiométriques. n(H2S)fin = 0 ; n(Cd2+ )fin =0.
Il se forme 0,010 mol de sulfure de cadmium et 2*0,010 = 0,020 mol d'ions H3O+aq.
|
|
On verse alors progressivement dans ce mélange, la solution aqueuse de soude de concentration molaire C1 = 1,0 mol/L.
Ecrire l'équation de la réaction de cette nouvelle méthode de dosage.
Couples acide / base : H3O+ aq/ H2O(l) et H2O(l) / HO- aq :
H3O+ aq + HO- aq = 2H2O(l)
Parmi les courbes suivantes, choisir celle obtenue en justifiant.
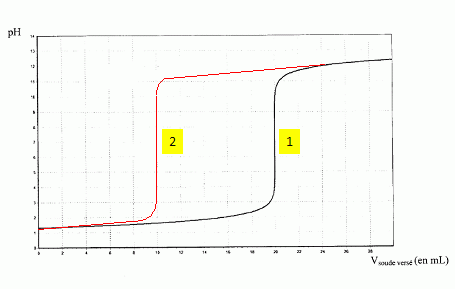
Quantité de matière initiale d'ions H3O+ aq : 0,020 mol.
Quanatité de matière d'ions hydroxyde versé à l'équivalence : C1 Véq = Véq mol.
A l'équivalence les quantités de matière mise en présence sont en proportions stoechiométriques : Véq =0,020L = 20 mL ( la courbe 1 convient).
Justifier l'intérêt de cette méthode pour faire un dosage du sulfure d'hydrogène.
On
remplace un dosage diacide faible base forte ( pour lequel on obtient
un seul saut de pH assez faible ) par un dosage acide fort base forte
pour lequel on observe un saut de pH important. Cette méthode est plus
précise. |
|
|