|
|
Cinétique d'une sunstitution nucléophile. (15 points)
On traite le (2R)-2-chlorobutane par des ions HO-, en maintenant la température constante.
Dans ces conditions le dérivé chloré, noté R-Cl, subit une substitution
nucléophile dont l'équation de la réaction est la suivante :
R-Cl + HO- = R-OH + Cl-.
On se propose de vérifier qu'il s'agit d'un mécanisme d'ordre 2 ( SN2).
Pour cela, on introduit dans un vase réactionnel un mélange équimolaire
d'une solution contenant le dérivé chloré R-Cl et d'une solution
contenant les ions hydroxyde HO- tel que :
[R-Cl]0 =[HO-]0 = C0 = 0,500 mol L-1.
La cinétique de cette réaction est suivie en déterminant la
concentration [R-Cl] restant dans le mélange réactionnel en fonction du
temps ; le mélange liquide garde un volume constant.
t(min)
|
0
|
10
|
20
|
30
|
60
|
120
|
[R-Cl] mol / L
|
0,500
|
0,357
|
0,277
|
0,227
|
0,147
|
0,086
|
1/ [R-Cl] L mol-1
|
1/0,500 = 2,00
|
1/0,357 =2,80
|
1/0,277=3,61
|
4,40
|
6,80
|
11,6
|
Donner
l'expression de la vitesse de réaction en fonction de la dérivée par
rapport au temps de la concentration molaire [R-Cl].
v = -d[R-Cl] / dt.
Donner l'expression de la vitesse de réaction en fonction des concentrations [R-Cl] et [HO-].
On supposera la cinétique d'ordre 1 par rapport à R-Cl et d'ordre 1 par rapport à HO- ; k est la constant de vitesse de la réaction.
v = -d[R-Cl] / dt= k[R-Cl] [HO-].
Montrer qu'on a la relation :1/[R-Cl] = kt +1/C0.
Les ordres partiels étant égaux à 1 et le mélange initial étant équimolaire, on a à chaque instant [R-Cl]=[HO-].
-d[R-Cl] / dt= k[R-Cl] [HO-] s'écrit : -d[R-Cl] / dt= k[R-Cl]2 ; d[R-Cl] /[R-Cl]2 =-k dt
d(-1/[RCl]) = -kdt ; d(1/[RCl]) = kdt
Intégrer entre 0 et t : 1/[RCl]-1/[RCl]0= kt ; 1/[RCl]-1/C0= kt ; 1/[RCl] = kt +1/C0.
|
|
En utilisant les données du tableau, vérifier que la réaction obéit à un mécanisme d'ordre global 2.
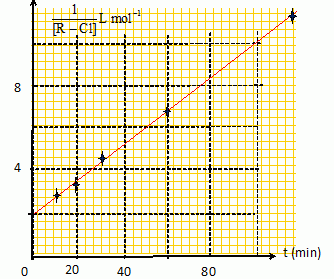
La courbe est une droite : l'hypothèse d'un ordre global égal à 2 est confirmée.
|
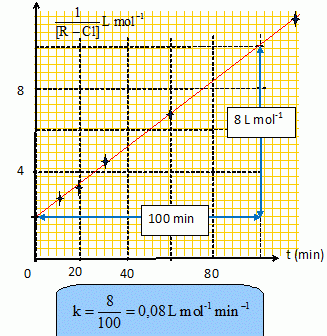
Déterminer la valeur de la constante de réaction.
Citer deux facteurs cinétiques influençant la vitesse d'une réaction chimique.
La température, la concentration des réactifs, un catalyseur.
Définir le temps de demi-réaction t½.
Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Si la transformation est totale, l'avancement final est égal à l'avancement maximal, alors à t½, [R-Cl]t½ = ½C0.
Donner l'expression littérale de t½.
à t½, [R-Cl]t½ = ½C0 ; 1/ [R-Cl]t½ =kt½+1/C0 ; 2/C0 =kt½+1/C0 ; 1/C0 =kt½ ; t½ = 1/(kC0).
Calculer t½.
t½ = 1/(kC0 ) = 1/(0,08*0,500) = 25 min.
Comment évolue t½ si on augmente la température ? Justifier.
La température est un facteur cinétique ; la constante de vitesse k augmente avec la température.
Or t½ = 1/(kC0 ) : à C0 constant, t½ diminue donc.
Chimie organique.
(15 points)
Structure moléculaire de A.
La molécule de composé A a pour formule semi-développée :
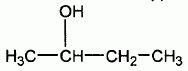
Citer le nom du groupe caractéristique présent dans cette molécule.
Le groupe -OH est appelé "hydroxy" : la molécule possède une fonction alcool secondaire.
Nommer cette molécule en nomenclature systématique.
butan-2-ol.
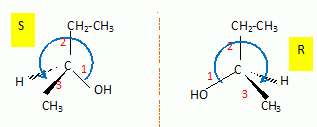
Donner
les représentations de Cram des deux isomères optiques de A. Quel nom
donne t-on à la relation d'isomérie liant les deux isomères optiques ?
Les deux isomères sont des énantiomères.
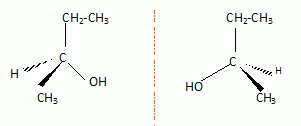
Donner la configuration absolue de l'atome de carbone asymétrique dans chaque isomère en précisant les règles utilisées.
Numéroter de façon décroissante chacun des quatre substituants selon son
numéro atomique.
(1) OH ; (2) CH3-CH2 ; (3) CH3 ; (4) H.
On place alors l'atome (ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le
carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le
carbone est Sinister (S).
|
|
Réactions d'oxydo-réduction.

Le composé B est une cétone.
Donner le nom et la formule semi-développée de B.
Butan-2-one.
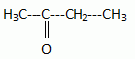
Ecrire les demi-équations électroniques mises en jeu dans la réaction (1).
On donne les couples d'oxydoréduction mis en jeu : C4H8O / C4H10O et MnO4- / Mn2+.
C4H10O = C4H8O + 2H+ + 2e-.
MnO4- + 8H+ + 5e- = Mn2++4H2O
En déduire l'équation de la réactiond'oxydoréduction mise en jeu.
5 fois { C4H10O = C4H8O + 2H+ + 2e-}
2 fois { MnO4- + 8H+ + 5e- = Mn2++4H2O}
Ajouter :
5C4H10O + 2MnO4- + 16H+ + 10e- = 2Mn2++8H2O + 5C4H8O + 10H+ + 10e-
Simplifier :
5C4H10O + 2MnO4- + 6H+ = 2Mn2++8H2O + 5C4H8O.
Effet du chauffage en milieu acide.
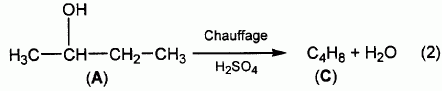
A quelle famille de réactions s'apparente la réaction (2) ? Est ce une addition, une substitution, une élimination.
L'alcool se déshydrate : une molécule d'eau est éliminée : donc réaction d'élimination.
La réaction (2) conduit au composé C, présent sous forme de deux isomères de position notés C1 et C2.
Donner les formues semi-développées et nommer C1 et C2.
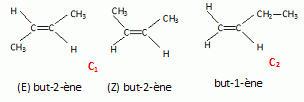
Parmi ces deux isomères, quel est celui qui se forme majoritairement ? Justifier.
Règle de Zaïtsev : lors d'une élimination sur un alcool, l'alcène le plus substitué au niveau de
la double liaison C=C ( le plus stable) est majoritaire.
C1 est majoritaire.
|
Action d'un chlorure d'acide.
On fait agir le chlorure d'éthanoyle sur le composé A.
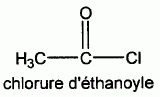
On obtient plusieurs produits dont un composé organique D.
Ecrire l'équation de la réaction.
Quelle fonction organique est présente dans le composé D ?
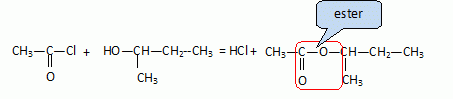
Quel est l'intérêt d'utiliser un chlorure d'acide plutôt qu'un acide carboxylique dans cette transformation ?
Avec le chlorure d'acide la réaction est totale ; avec l'acide
carboxylique correspondant, la réaction est limitée par l'hydrolyse de
l'ester.
|
|