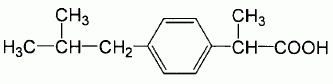
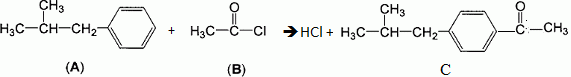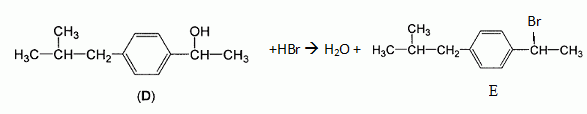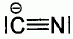L'ibuprofène
est un analgésique ( anti-douleur ) et un anti-inflammatoire au même
titre que l'aspirine. La formule semi-développée de l'ibuprofène est
donnée ci-dessous :
Une première étape de la synthèse consiste à faire réagir les réactifs
A et B représentés ci-dessous, en présence de chlorure d'aluminium AlCl3.
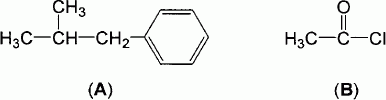
Un mélange de deux produits isomères est obtenu : C majoritaire et C'
minoritaire.
Donner les noms des
deux réactifs en utilisant la nomenclature officielle.
A :
1-phényl-2-méthylpropane ; B : chlorure d'éthanoyle.
Ecrire
l'équation de la réaction conduisant à l'isomère C.
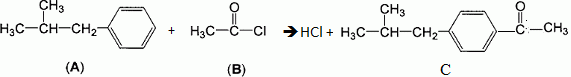
|
Donner le nom de la
réaction entre A et B.
Acylation du noyau
benzénique
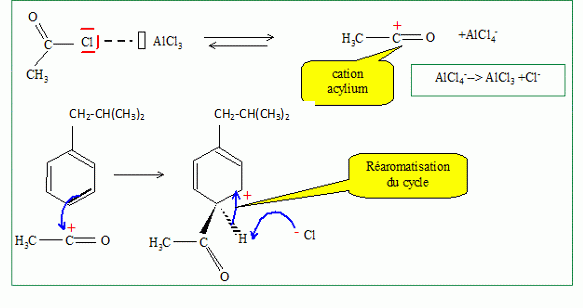
Expliciter
les différentes étapes du mécanisme de cette réaction.
|
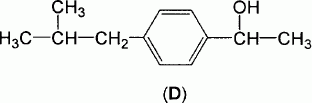
La deuxième
étape est la réduction du composé C par le borohydrure de sodium NaBH4.
On obtient le composé D représenté ci-dessous.
Lors de la troisième étape la molécule D est mise en présence de
bromure d'hydrogène : on observe la formation de plusieurs produits,
notamment un composé E de formule brute C12H17Br.
Ecrire
l'équation complète de la réaction en faisant apparaître la formule
semi-développée de E.
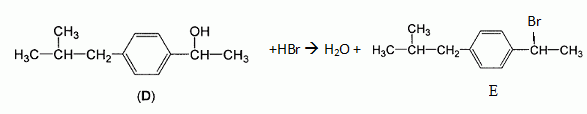
Parmi les
mots suivants le(s)quel(s) pourrai(en)t qualifier la réaction de
formation de E :
addition, substitution,
élimination, électrophile, radicalaire, nucléophile.
Substitution radicalaire en position benzylique.
La quatrième étape
de la synthèse permet l'obtention du composé F par action du cyanure de
sodium sur E, selon l'équation d réaction suivante :
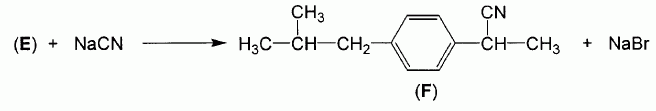
Quel est le nom de
la fonction chimique apparue
?
Nitrile.
Le cyanure de sodium NaCN est un composé ionique. L'ion cyanure a pour
formule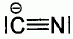
Pour
quelle raison l'ion cyanure est une espèce nucléophile et pourquoi la
réaction s'apparente alors à une substitution nucléophile ?
L'atome de carbone de cet ion est très riche en électrons ( il porte un
doublet non liant ) : c'est un site nucléophile.
Un composé nucléophile attaque un site électrophile ( position
benzylique ).
|
La cinquième étape de la synthèse
consiste en une hydrolyse acide à chaud de la molécule F qui conduit à
l'ibuprofène.
L'ibuprofène peut exister sous formes de deux énantiomères.
Expliciter cette
affirmation.
La présence d'un carbone asymétrique
conduit à l'existence de deux énantiomères.
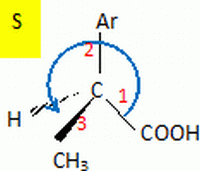
Seul l'énantiomère de configuration absolue S de l'ibuprofène présente
une activité thérapeutique.
Représenter cet
énantiomère en citant les règles utilisées ( on pourra noté Ar
le groupe comportant le noyau benzénique )
Numéroter de
façon décroissante chacun des quatre substituants
selon son numéro atomique.
COOH (1) ; Ar (2) ; -CH3
(3) ; H (4).
On place alors l'atome
(ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel
sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation
est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation
est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
La
séparation des deux énantiomères étant couteuse et délicate, ce
médicament est souvent commercialisé sous forme d'un mélange
équimolaire des deux énantiomères.
Comment
nomme t-on un tel mélange ?
Mélange racémique.
|
|
|