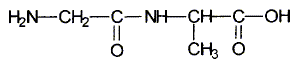Quand
une personne consomme de l'alcool, celui-ci commence à passer
immédiatement dans le sang, essentiellement au niveau de l'estomac et
de l'intestin, pour être distribué dans tout l'organisme. La
quasi-totalité de l'alcool présent dans le sang est alors
progressivement oxydé par le foie ( la quantité non transformée est
éliminée via l'haleine, les urines et la sueur).
Conduite en état d'ivresse.
le
code de la route défini la conduite à l'état d'ivresse comme la
conduite de tout véhicule lorsque la concentration d'alcool est
supérieure ou égale à 0,50 g/L dans le sang ou supérieure ou
égale à 0,25 mg/L dans l'air expiré. Pour doser l'éthanol présent dans
un échantillon de sang humain, on propose la méthode suivante : on
prélève un volume de sang que l'on dissout dans une solution d'acide
picrique. On distille l'ensemble et on récupère le distillat ( V1
= 5,0 mL )contenant la totalité de l'éthanol initialement présent dans
l'échantillon de sang. le distillat est ensuite dosé par un mélange
sulfochromique ( solution de dichromate de potassium 2K+aq + Cr2O72-aq et d'acide sulfurique ). La concentration molaire en ion dichromate contenus dans une solution titrante est C2 = 3,0 10-3 mol/L. L'équivalence est obtenue lorsqu'on a versé un volume de dichromate de potassium V2 = 15,8 mL.
Ecrire les demi-équations des couples d'oxydo-réduction mis en jeu puis l'équation de la réaction support du dosage.
Couples oxydant /réducteur : CH3COOH / C2H5OH : E°2 =0,05 V ; Cr3+ / Cr2O72- : E°1 =1,34 V.
3 fois {
C2H5OH
+H2O =
CH3COOH +
4H+ + 4e-
}
oxydation alcool.
2 fois {
Cr2O72-
+ 14H+ + 6e-
= 2Cr3+ + 7
H2O
} réduction de l'ion
dichromate.
3C2H5OH +
2Cr2O72-
+16H+=
3CH3COOH + 4Cr3+ + 11
H2O
(1)
Justifier, sans calcul, le sens d'évolution de cette réaction.
E°1 -E°2 étant supérieure à 0,3 V, cette réaction évolue dans le sens direct.
|
Définir
l'équivalence du titrage et montrer qu'à l'équivalence, les quantités
de matière d'alcool dans le distillat dosé et les ions dichromate
versés à l'équivalence vérifient la relation :
n(alcool) =1,5 n(dichromate).
A l'équivalence, les quantités de matière des réactifs sont en
proportins stoechiométriques. Avant l'équivalence,l'un des réactifs est
en excès, après l'équivalence, l'autre réactif est en excès.
3 mol d'alcool réagissent avec 2 mol d'ion dichromate.
1 mol d'alcool réagissent avec 2/3 mol d'ion dichromate.
n (alcool) réagissent avec n(dichromate) =2/3n(alcool).
D'où n(alcool) = 1,5 n(dichromate).
|
Calculer les concentrations molaire C1 et massique Cm de la solution alcoolique et conclure.
n(alcool) = 1,5 n(dichromate) ; V1C1
=
1,5 C2 V2 ; C1
=
1,5 C2 V2 /V1 = 1,5* 3,0 10-3 * 15,8 / 5,0 =1,422 10-2 ~1,4 10-2 mol/L.
M(alcool) = 46 g/mol ; Cm = C1 M(alcool) = 1,422 10-2 *46 =0,65 g/L, valeur supérieure à 0,50 g/L : la conduite d'un véhicule n'est pas possible.
L'acide picrique a pour formule brute C6H3N3O7.
En vieillissant, une solution d'acide picrique peut cristalliser. Les
cristaux formés sont sensibles à la friction et celle-ci peut causer la
décomposition détonante de l'acide picrique. Il faut donc contacter une
société habilitée à le récupérer pour l'acheminer vers un centre de
traitement. La décomposition de l'acide picrique solide conduit à la
formation de quatre espèces chimiques gazeuses : monoxyde de carbone,
diazote, dihydrogène et eau. Cette réaction est symbolisée par
l'équation :
C6H3N3O7(s) = 6CO(g) + 1,5 N2(g) + ½H2(g) + H2O(g).
Calculer l'enthalpie standard de cette réaction à 298 K et interpréter son signe.
| CO(g) | H2O(g) | C6H3N3O7(s) |
| DfH° ( kJ / mol) | -110,5 | -241,8 | -217,9 |
DrH° = 6 DfH°(CO) + DfH°(H2O)-DfH°(C6H3N3O7) = -6*110,5 -241,8 +217,9 = -687 k/mol.
DrH° est négatif, la réaction est donc exothermique.
Durée de décomposition de l'alcool dans l'organisme.
La cinétique de décomposition de l'alcool dans le sang peut être modélisée, de façon élémentaire, en deux étapes :
1ère étape
: absorption : passage de l'alcool du milieu extérieur ( tube digestif
) au milieu intérieur ( sang) à travers les parois stomacale et
intestinale, processus qui obéit à une cinétique d'ordre 1.
2ème étape : transformation : oxydation de l'alcool dans le sang, par le foie essentiellement.
On
s'interesse, ici, à la cinétique de l'oxydation de l'alcool dans le
sang mise en jeu durant la deuxième étape. Pour cela, on injecte
directement dans le sang une certaine quantité d'éthanol, puis on le
dose régulièrement au curs du temps. l'origine des dates est choisie au
moment de l'injection, que l'on considère comme instantanée. On obtient
les résultats suivants :
| t(min) | 0 | 120 | 240 | 360 | 480 | 600 |
| C(mol/L) | 4,5 10-2 | 3,6 10-2 | 2,8 10-2 | 1,9 10-2 | 1,0 10-2 | 1,5 10-3 |
La vitesse volumique de la réaction d'oxydation s'exprime par la relation v = -dC/dt.
Montrer que cette vitesse est constante et a une valeur proche de 7 10-5 mol L-1 min-1.
La courbe C = f(t) est une droite, donc son coefficient directeur dC/dt est constant.
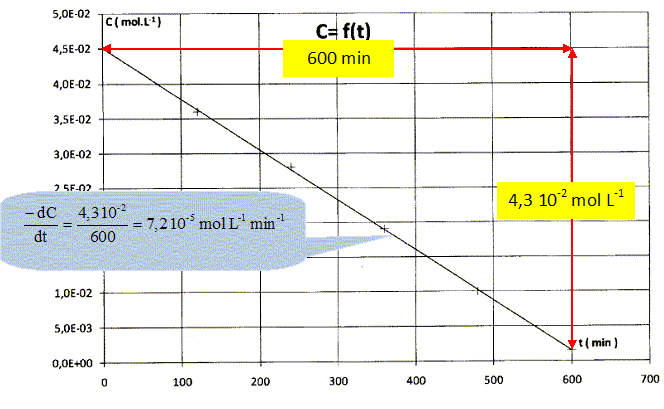
Quel est l'ordre de cette réaction ?
C = -7,2 10-5 t + 4,5 10-2 avec v = 7,2 10-5 mol L-1 min-1. La réaction est d'ordre zéro.
En
tenant compte des deux étapes, absorption et oxydation, la résolution
mathématique du problème conduit à la courbe dont l'allure est donnée
ci-dessous ( l'origine des dates correspond au moment de la prise
d'alcool ). la concentration de l'alcool dans le sang augmente
progressivement pour atteindre une valeur maximale au bout d'un temps tm
( compris entre 30 et 60 minutes selon l'individu ). Elle diminue
ensuite de façon afine au cours du temps. On montre que la vitesse de
disparition vaut : v = 7,0 10-5 mol L-1 min-1.
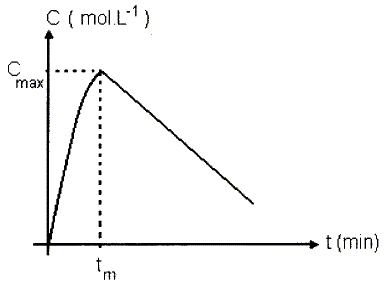
A partir de l'instant tm, calculer la durée Dt
au terme de laquelle le conducteur pourra prendre levolant, c'est à
dire quand la concentration massique de l'alcool dans le sang sera
inférieure à la limite légale de 0,50 g/L. On pourra prendre Cmax = 1,9 10-2 mol L-1 ).
C =-7,0 10-5 t + 1,9 10-2.
0,50 g/L = 0,50 / M(alcool) mol/L ; 0,50 / 46 =1,087 10-2 mol/L.
1,087 10-2 = -7,0 10-5 Dt + 1,9 10-2. Dt = (1,9 10-2 -1,087 10-2 ) / 7,0 10-5= 116 min ~ 2 heures.
Hypoalbuminémie.
La
consommation d'alcool conduit à une modification quantitative et
qualitative des cellules hépatiques ( destruction des hépatocytes,
multiplication et différenciation des autres cellules du foie ). Si
elle est excèssive et prolongée, cette consommation peut conduire à une
cirrhose. Un des signes biologiques qui lui est associé est la baisse
du taux d'albumine, protéine sérique synthétisée par le foie.
l'albumine
est constituée de plusieurs centaines d'acides aminés, dont les plus
simples, la glycine et l'alanine sont représentés ci-dessous :
Entourer et nommer les groupes fonctionnels présents dans la glycine.
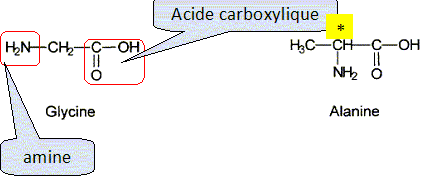
Parmi
les deux acides aminés ci-dessus, représenter celui qui possède un
carbone asymétrique en repérant ce dernier par un astérisque (*).
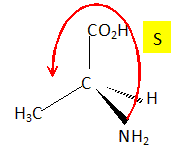
Représenter en perspective de Cram, son stéréoisomère de configuration S. ( le classement des substituants est exigé ).
Numéroter de façon décroissante chacun des quatre substituants
selon son numéro atomique.
NH2 (1) ; COOH (2) ; -CH3
(3) ; H (4).
On place alors l'atome (ou le groupement) de numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
|
La formule semi-développée suivante est celle du dipeptide Gly-Ala.
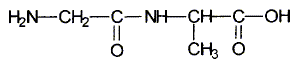
En représentant la glycine par la formule R-COOH et l'alanine par la formule R'-NH2, écrire l'équation de la réaction conduisant au dipeptide Gly-Ala.
R- COOH + R'-NH2 = RCO-NH-R' + H2O.
Nommer la liaison formée.
La liaison formée est une liaison peptidique.
Le dipeptide Gly-Ala pourrait-il réagir avec d'autres acides aminés ? Justifier.
Le
dipeptide Gly-Ala possède un groupe acide carboxylique et un groupe
amine : il peut donc réagir avec d'autres acides aminés pour conduire
des polypeptides.
|
|
|