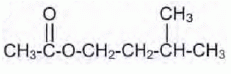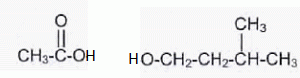L'eau,
bien précieux qupeut se faire rare dans de nombreuses régions, est
essentielle dans différents domaines comme par exemple :
- en biologie : l'eau est le principal constituant des tissus animaux
et végétaux
- dans l'idustrie :l'eau se prète à des applications nombreuses et
variées. ( solvant, agent de lavage et de réfrigération, matière
première )
L'eau
en tant que boisson.
Les indications portées sur une bouteille d'eau minérale sont les
suivantes :
calcium Ca2+ : 555 mg/L ; magnésium Mg2+ : 110
mg/L ; sodium Na+ : 14 mg/L ; hydrogénocarbonate : HCO3- : 403 mg/L
résidu sec à 180°C :1850 ; pH = 7,0.
pKa1(CO2, H2O/HCO3- ) =6,4 ; pKa2(HCO3- /CO32-)
=10,3. Masse molaire de HCO3- : 61 g/mol.
L'ion hydrogénocarbonate.
Ecrire
les demi-équations acido-basiques associées à cet ion.
HCO3- aq = CO32- aq + H+aq.
HCO3- aq + H+aq= CO2, H2O
Tracer le
diagramme de prédominance des espèces acides et basiques des couples
auquels appartient l'ion hydrogénocarbonate.
Quelle espèce prédomine dans l'eau minérale ?

A pH=7, inférieur à pKa2, supérieur à pKa1, la
forme HCO3- aq prédomine.
|
Teneur en ion hydrogénocarbonate
:
On prélève un volume V1 = 20 mL d'eau minérale auquel est
additionnée progressivement une solution d'acide chlorhydrique de
concentration C= 1,0 10-2 mol/L.
La réaction chimique qui se produit s'écrit :
HCO3- aq +H3O+aq = CO2, H2O aq + H2O (1)
Donner
l'expression
du quotient de réaction.
Qr, = [CO2, H2O aq]/ ([H3O+aq] [HCO3- aq] ).
Montrer
que Qr, éq =2,5 106. Cette valeur
dépend-elle de la composition initiale du système ?
HCO3- aq + H+aq= CO2, H2O ; Ka1
= [CO2, H2O aq]/ ([H+aq] [HCO3- aq] ).
Qr, éq =1 / Ka1 =1/ 10-6,4 =106,4
=2,5 106.
Cette valeur ne dépend
pas de la composition initiale du système ; elle ne dépend que de la
température.
Préciser,
sans calcul, la valeur du taux d'avancement à l'équilibre, si
l'on veut utiliser la réaction chimique (1) pour le dosage des ions
hydrogénocarbonate. Justifier.
Une réaction chimique, support d'un dosage doit être rapide et totale :
le taux d'avncement à l'équilibre vaut donc 1.
|
Définir
l'équivalence d'un dosage.
A
l'équivalence, les réactifs sont en proportions stoechiométriques ;
avant l'équivalence, l'un des réactifs est en excès, après
l'équivalence, l'autre réactif est en excès.
Déterminer les
coordonnées du point d'équivalence.
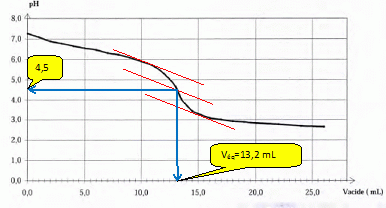
Calculer
la concentration des ions hydrogénocarnonate dans cette eau. La
comparer avec l'indictaion de la bouteille.
A l'équivalence CVéq = C1V1 ; C1=CVéq
/V1 =0,010*13,2 / 20 = 6,6 10-3 mol/L.
Titre massique en ion hydrogénocarbonate : 61*6,6 10-3 ~0,40
g/L = 4,0 102 mg/L ( en accord avec l'indication )
Le
dosage des ions hydrogénocarbonate peut-il être réalisé par
colorimétrie en utilisant un indicateur coloré ? Justifier et choisir
l’indicateur le plus approprié dans la liste.
Vert de bromocrésol : jaune 3,8 – 5,4 bleu
Bleu de bromothymol : jaune 6,0 – 7,5 bleu
Phénolphtaléïne : incolore 8,2 – 10,0 rose.
Toutes les espèces, réactifs et produits, sont incolores ; le dosage
peut être suivi par colorimétrie en utilisant un indicateur coloré.
La zone de virage de l'indicateur doit contenir le pH du point
équvalent ( pH=4,5). Le vert de bromocrésol convient.
L’eau en chimie
organique :
Les esters, des
molécules odorantes :
Les esters et les produits de leur hydrolyse sont des espèces chimiques
très répandues dans la nature. L’acétate d’isoamyle est l’un des esters
à odeur fruitée contenus dans les bananes. Sa formule semi-développée
est la suivante :
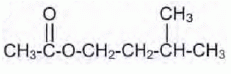
La synthèse de l’acétate d’isoamyle peut être réalisée à partir de deux
réactifs : l’acide éthanoïque ou acétique et le
3-méthylbutan-1-ol ou alcool isoamylique.
Ecrire les formules semi-développée des deux réactifs cités.
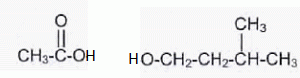
Dans un montage à reflux, on introduit 6,5 g d’acétate d’isoamyle et
0,90 g d’eau. Le mélange réactionnel est chauffé pendant une heure à
75°C environ.
Ecrire l’équation de la réaction produite.
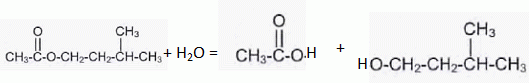
Calculer les quantités de matière initiales d’ester et d’eau
introduites dans le mélange réactionnel.
M(ester) =7*12+14+2*16 = 130 g/mol
n(ester) = m/M = 6,5 / 130 = ,050 mol ; n(eau) = m/M(eau) = 0,90/18 = 0,05 0 mol.
Le quotient de réaction à l’équilibre pour cette réaction est Qr
éq = 0,25.
Calculer le quotient de réaction initial et déduire le sens d’évolution
du système chimique.
Qr i = [acide éthanoïque]i [alcool isoamylique]i / ( [ester]i[eau]i)
Or [acide éthanoïque]i =[alcool isoamylique]i =0 donc Qr i = 0.
Qr i < Qr
éq : le système chimique évolue dans le sens direct.
Compléter le tableau d’avancement et déterminer l’avancement à l’état
d’équilibre.
|
avancement (mol)
|
ester
|
eau
|
acide éthanoïque
|
alcool isoamylique
|
initial
|
0
|
0,05
|
0,05
|
0
|
0
|
en cours
|
x
|
0,05-x
|
0,05-x
|
x
|
x
|
équilibre
|
xéq
|
0,05-xéq |
0,05-xéq |
xéq |
xéq |
Qr
éq = 0,25 = [xéq / (0,05-xéq)]2 ; 0,5 =xéq / (0,05-xéq) ; 0,025 -0,5 xéq = xéq ; xéq = 0,0167 ~0,017 mol.
|
Influence des conditions initiales :
L’hydrolyse d’un ester est une réaction limitée.
Lorsque l’état d’équilibre est atteint à 75 °C, la quantité de matière
d’ester non hydrolysée est égale à 3,3 10-2 mol.
Préciser s’il
reste la même quantité de matière d’ester à l’équilibre dans les
conditions suivantes :
- les quantités initiales d’ester et d’eau sont identiques à celles de la
question précédente, la température est égale à 95 °C.
La température est un facteur cinétique ; l'équilibre est plus
rapidement atteint à 95°C qu'à 75 °C, mais la composition du système
chimique à l'équilibre n'est pas modifiée.
- la quantité de matière initiale d’ester est identique, on introduit
dans le mélange initial 100 mL d’eau, la température est égale à 75°C.
L'eau est en large excès ; l'équilibre est déplacé dans le sens de la
consommation d'eau, dans le sens direct : il se forme d'avantage
d'acide et d'alcool. La composition du mélange à l'équilibre est
modifiée.
|
|